Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Клиническая энзимология. Различают энзимопатологию, энзимодиагностику и энзимо терапию.Содержание книги
Поиск на нашем сайте
Энзимопатология это заболевания, которые обусловлены отсутствием или снижением ак тивности ферментов. В основном это – наследственные болезни, обусловленные генетиче скими нарушениями. Их называют молекулярными болезнями. Например:
• дефекты ферментов обмена фенилаланина возникают при снижении активности фенилаланингидроксилазы (фенилпировиноградная олигофрения) • дефект галактозо1фосфатуридилтрансферазы) галактоземия; • дефекты ферментов обмена гликогена – гликогенозы; • дефекты ферментов обмена липидов – липидозы, болезнь НиманаПика и др. Энзимодиагностика это использование определения активности ферментов в биологиче ских жидкостях для выявления тех или иных заболеваний. Так, повышение активности ала нинаминотрансферазы и ЛДГ5 в сыворотке крови свидетельствует о поражении печени (гепатиты), повышение активности сывороточной аспартатаминотрансферазы и ЛДГ1 встреча ется при инфаркте миокарда, повышение активности амилазы в моче остром панкреатите. Энзимотерапия это использование ферментных препаратов для лечения заболеваний. Так, в качестве заместительной терапии при болезнях желудка назначают пепсин, для усиле ния переваривания пищи применяют ферменты поджелудочной железы (препараты фестал, мезим); для разжижения мокроты применяют ингаляции с трипсином; для рассасывания со единительнотканных рубцов – фермент гиалуронидазу; при растворения тромбов – фибри нолизин, стрептокиназа и др.
21. Изоферменты. Значение спектра изоферментов для диагностики заболеваний. Изменчивость изоферментов в онтогенезе(на примере ЛДГ)
Изоферменты – это изофункциональные белки. Они катализируют одну и ту же реакцию, но отличаются по некоторым функциональным свойствам в силу отличий по: - аминокислотному составу; - электрофоретической подвижности; - молекулярной массе; - кинетике ферментативных реакций; - способу регуляции; - стабильности и др. Изоферменты – это молекулярные формы фермента, различия в аминокислотном составе обусловлены генетическими факторами. Примеры изоферментов: глюкокиназа и гексокиназа.
Гексокиназа может фосфорилировать любой шестичленный цикл, гексокиназа – только превращение глюкозы. После приёма пищи, богатой глюкозой, глюкокиназа начинает работать. Гексокиназа – стационарный фермент. Он катализирует реакцию расщепления глюкозы при низких её концентрациях, поступающих в организм. Отличаются по локализации (глюкокиназа – в печени, гексокиназа – в мышцах и печени), физиологическому значению, константе Михаэльса. Если фермент – олигомерный белок, то изоформы могут получаться в результате различной комбинации протомеров. Например, лактатдегидрогеназа состоит из 4-х субъединиц. Н – субъединицы сердечного типа, М – мышечного. Может быть 5 комбинаций этих субъединиц, а, следовательно, и 5 изоферментов: НННН (ЛДГ1 – в сердечной мышце), НННМ (ЛДГ2), ННММ (ЛДГ3), НМММ (ЛДГ4), ММММ (ЛДГ5 – в печени и мышцах). [рис. эти 4 буквы в кружочки. Надо отличать изоферменты от множественных форм ферментов. Множественные формы ферментов – это ферменты, которые получают свои различия уже после их синтеза, например фосфорилаза A и B.
Значение изоферментного спектра Анализ спектра изоферментов в количественном и качественном отношениях в разл. тканях и органах человека имеет большое значение для диагностики нек-рых заболеваний, в т. ч. и связанных с генетич. аномалиями. Напр., инфаркт миокарда сопровождается резким увеличением активности двух форм лактатдегидрогеназ - a4 и b4, причем эта аномалия сохраняетсядлит. время и может служить показателем течения болезни. Разл. формы гепатита сопровождаются изменениями спектров аспартатаминотрансферазы, малатдегидрогеназы, щелочной фосфатазы и нек-рых др. ферментов. При диагностике ряда онкологич. заболеваний данные по анализу спектра изоферментов являются важным подтверждением диагноза и используются для прогноза метастазирования. ЛДГ- лактатдегидрогеназа(в мышцах находится фермент этот)
анализ на ЛДГ входит в Биохимический анализ крови. Нормы:
В ходе онтогенеза изменяется изоферментный спектр ЛДГ. В экстрактах из скелетных мышц 3–5-месячного эмбриона на долю изоферментов ЛДГ3 и ЛДГ2 приходится соответственно 40 и 31% от общей активности ЛДГ. В процессе эмбрионального развития в скелетной мускулатуре происходят постепенное возрастание активности катодных и снижение активности анодных изофер-ментов ЛДГ, так что у взрослых особей в скелетной мускулатуре наибольшей активностью обладают уже изоферменты ЛДГ5 и ЛДГ4. 22. Структурные компоненты нуклеиновых кислот. Биологическое значение и функции нуклеиновых кислот. История их изучения. Структура.
23. Строение и уровни организации нуклеиновых кислот. Первичная структура нуклеиновых кислот. Видовые различия первичной структуры нуклеиновых кислот.
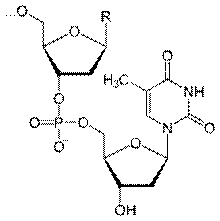
Имеют несколько уровней структурной организации. 1. первичная структура. РНК и ДНК построены однотипно – представлены полинуклеотидной цепью, состоящей из отдельных мононуклеотодов, соединённых между собой 3’→5’-фосфодиэфирными связями. Эта связь образуется между фосфорным остатком одного мононуклеотида и 3’-ОН-группой пентозного остатка другого мононуклеотида. [рис. образования такой связи] Разные НК отличаются числом, порядком чередования и составом НК. 2. вторичная структура. По рентгеноструктурному анализу ДНК в 1953г Уотсон и Крик предложили модель строения ДНК, которая объясняла самовоспроизведение организмов, наследственную изменчивость. Вторичная структура представляет собой двойную спираль, состоящую из 2 полинуклеотидных цепей, закрученных вокруг одной общей оси. Эти цепи антипараллельны, т.е. одна идет в направлении 5’→3’, а другая 3’→5’. Пуриновому основанию одной цепи соответствует пиримидиновое основание другой цепи – эти основания комплиментарны друг другу, т.е. дополняют одно другое до целого. Между А и Т две водородные связи (А=Т), а между Г и Ц – 3 (ГºЦ). Молекула спирализована на всем протяжении, гидрофобные участки внутри спирали, их плоскости перпендикулярны основаниям и параллельны друг другу. В вертикальном направлении возникают гидрофобные взаимодействия. Вторичная структура стабилизируется водородными связями и гидрофобными взаимодействиями. Вторичная структура РНК более простая, представляет собой одну полинуклеотидную цепь, в которой спирализованы лишь некоторые участки. Вторичная структура РНК представлена в виде клеверного листа. Для тРНК известна третичная структура в форме буквы Г. [рис. РНК в виде клеверного листа] Видовые различия первичной структуры
Вторичная структура ДНК Наиболее распространённой формой вторичной структуры ДНК является двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль[5]. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году[6]. В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
В зависимости от внешних условий параметры двойной спирали ДНК могут меняться, причём иногда существенно. Правоспиральные ДНК со случайной нуклеотидной последовательностью можно грубо разделить на два семейства — А и В, главное отличие между которыми — конформациядезоксирибозы. К В-семейству также относятся С- и D-формы ДНК[7]. Третичная структура
В стабилизации третичной структуры белка принимают участие:
Хроматин
Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется(не синтезируется РНК)- обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов — ацетилированием и фосфорилированием Считается, что в ядре существуют так называемые функциональные домены хроматина (ДНК одного домена содержит приблизительно 30 тысяч пар оснований), то есть каждый участок хромосомы имеет собственную «территорию». Вопрос пространственного распределения хроматина в ядре изучен пока недостаточно. Известно, что теломерные (концевые) и центромерные (отвечающие за связывание сестринских хроматид в митозе) участки хромосом закреплены на белках ядерной ламины. Ядерная ламина — фибриллярная сеть жесткой структуры, подстилает ядерную мембрану (находится под ядерной мембраной), участвует в организации хроматина.
В цитоплазме клеток присутствуют три типа РНК: – транспортные (тРНК), матричные (мРНК) и рибосомальные (рРНК). Они различаются по первичной структуре, молекулярной массе, конформации, продолжительно- сти жизни и выполняемым функциям. Первичная структура РНК – порядок чередования рибонуклеозидмоно фосфатов в полинуклеотидной цепи. Нуклеотиды в РНК, как и в ДНК связа- ны 3′,5′-фосфодиэфирными связями. На одном конце полинуклеотидной цепи находится фосфорилированная ОН-группа 5′- углеродного атома, на другом – ОН-группа 3′-углеродного атома рибозы. Гидроксильная группа у 2′- углеродного атома рибозы делает молекулу РНК нестабильной. Для всех ти- пов РНК характерно наличие специализированных участков. Отдельные уча- стки РНК за счет водородных связей с комплементарными азотистыми осно- ваниями образуют петли – «шпильки». Участки цепи РНК спиральных струк- турах антипараллельны, но не всегда полностью комплементарны. В них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не образующие двойную спираль. Транспортные РНК Независимо от различий в последовательности нуклеотидов, простран- ственная структура любых тРНК описывается универсальной моделью «кле- верного листа». Последовательность тРНК включают 70-90 нуклеотидов и около 10% минорных компонентов. Структура «клеверного листа» состоит из четырех или пяти двуцепочечных спиральных стеблей и трех петель. Каждый стебель содержит 4-7 пар комплементарных оснований. Разли- чают акцепторный, антикодоновый, дигидроуридиловый, псевдоуридиловый и добавочный «стебли». Акцепторный «стебель» содержит 3′- и 5′-концы по- линуклеотидной цепи. К 3′-концу, оканчивающемуся CCA-ОН, присоединя- ется специфическая аминокислота, отвечающая последовательности антико- донового триплета в антикодоновой петле. Число нуклеотидов в «стеблях» и петлях, кроме вариабельной петли, постоянно (от 4 до 21 нуклеотида). Раз- ные тРНК содержат инвариантные основания (присутствуют во всех тРНК), ответственные в «третичных» взаимодействиях за образование Г-образной структуры Г-образная структура состоит из двух спиралей расположенных почти перпендикулярно в А-РНК, длина которой равна около 7 нм, ширина – 2 нм. Одну спираль образуют «уложенные» друг за другом антикодоновый (А) и дигидроуридиловый (D) «стебли», другую – акцепторный и псевдоуридило- вый (Т) «стебли». В состав тРНК входят минорные основания, представлен- ные метилированными основаниями, изомерами и аналогами пиримидинов. Минорные основания выполняют две функции: они делают тРНК устойчи- выми к действию нуклеаз и поддерживают определенную третичную струк- туру молекулы, т.к. не участвуют в образовании комплементарных пар и препятствуют спирализации определенных участков тРНК. Антикодон имеет жесткую архитектуру, которая позволяет ему быстро считывать матричную РНК. Матричные РНК Матричные РНК эукариот и прокариот различаются по строению. Бо- лее сложную организацию имеют матричные РНК. Этот тип РНК, независи- мо от уникальности кодирующих последовательностей нуклеотидов, имеет одинаковое строение 5′- и 3′-концов. Схема строения матричной РНК эукариот На 5′ конце присутствует модифицированный нуклеотид 7- метилгуанозин-5′-трифосфат – кэп (от англ. сар – «шапочка», рис. 11.7). Не- сколько десятков нуклеотидов (5′-нетранслируемая область) отделяют кэп от инициирующего кодона, (обычно это – -AUG-), далее идет кодирующий уча- сток, а за ним следует один из терминирующих кодонов (-UGA-, -UUA-, - UAG -). За стоп-кодоном идет 3′-нетранслируемая область и далее полиаде- нилатный «хвост», состоящий из 50-400 оснований. Полагают, что полиаде- нилатная область молекулы мРНК участвует в процессинге мРНК, предопре- деляет время жизни мРНК, способствует переносу мРНК из ядра в цитоплаз- му и принимает участие в трансляции. Предполагают, что вторичная (спира- лизация сама на себя) и третичная структуры менее компактны, чем тРНК и рРНК. Рибосомальные РНК Они принимают участие в образовании рибонуклеопротеинов, форми- рующих немембранные комплексы – рибосомы. Клетки прокариот и эукари- от содержат рибосомы, имеюшие общий план строения. В рибосомы входят высокомолекулярные рРНК, дающие начало 30S-40S- и 50S-60S-субчастицам рибосом; рРНК взаимодействуют с мРНК и аминоацил-тРНК в процессе трансляции. 5S-рРНК выступает в роли посредника между пептидилтрансфе- разным центром и доменом белкового фактора трансляции, обладающим GTP-азной активностью. Рибосомальные РНК содержат несколько модифицированных нуклео- тидов. Чаще всего это метильные производные азотистых оснований или ри- бозы. Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи. Биспиральные и линейные участки этих молекул формируют постоянные вариабельные домены, которые затем укла- дываются в более компактные структуры более высокого порядка.
25.Физико-Химические свойства нуклеиновых кислот. Денатурация и ренатурация. Молекулярная гибридизация нуклеиновых кислот.
Коллоидные свойства характерны для всех высокомолекулярных веществ. При растворении их образуются вязкие растворы типа коллоидов, истинные растворы можно получить толь при большом разведении. Гидрофильность нуклеиновых кислот зависит в основном от фосфатов. В растворах нуклеиновые кислоты имеют вид полианиона с резко выраженными кислыми свойствами. При физиологических значениях рН все нуклеиновые кислоты – полианионы и окружены противоанионами из белков и неорганических катионов. Растворимость двуспиральной ДНК хуже, чем односпиральная РНК. Денатурация свойственна макромалекулам, имеющим пространственную организацию. Она может быть вызвана нагреванием, воздействием химических веществ, которые нарушают Ван-дер-Вальсовы взаимодействия, разрывают водородные связи, стабилизирующие вторичную и третичную структуры.
При нагревании происходит разделение двунитевой ДНК на одиночные полинуклеотидные цепи. При медленном охлаждении они снова воссоединяются по принципу комплементарности, образуются нативная двунитевая полинуклеотидная цепь ДНК – этот процесс называется ренатурацией и при быстром охлаждении она не происходит.
Факторы денатурации такие же, как для белков, но к ним можно добавить механическое воздействие. Поскольку молекула ДНК спирализована, то мех. воздействие приводит к разрыву связей, поскольку молекула находится в напряженном состоянии, то она раскручивается. В отношении РНК механическое воздействие имеет меньший эффект. Ренатурация нуклеиновых кислот при снятии воздействия может осуществляться лишь до вторичной структуры, т.к. структуры высшего порядка образуются при участии ферментов с затратой энергии. Так же как и у белков, денатурация бывает полной и частичной, обратимой и необратимой. Необратимой будет при разрушении фосфодиэфирных связей между нуклеотидами.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 624; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.2 (0.01 с.) |