
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение клаузиуса-клапейронаСодержание книги
Поиск на нашем сайте
Рассмотрим равновесие чистого вещества в двух фазах однокомпонентной системы при превращении одной фазы в другую. dm(a) = - S(a) dT + V(a) dP dm(b) = - S(b) dT + V(b) dP dm(a) = dm(b) - S(a) dT + V(a) dP = - S(b) dT + V(b) dP (S(b) - S(a) ) dT = (V(b) - V(a)
DS =
На примере воды а) плавление - кристаллизация a - лед b - жидкость Lпл > 0
DV < 0
P
б) испарение Vпара >> V ж V =
dlnP = Lисп lnP = -
T в) возгонка Lвозг = Lпл + Lисп
  Р Р
Т Интегрирование уравнения от Р1 до Р2 и Т1 до Т2 ln
ОДНОКОМПОНЕНТНАЯ СИСТЕМА ВОДЫ
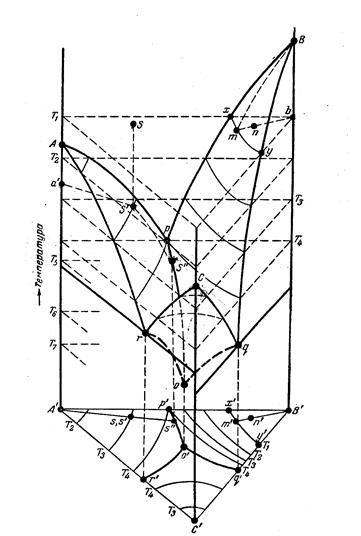
C = K + 2 - Ф С = 3 - Ф С1 = 3 -1 = 2 С2 = 3 - 2 = 1 С3 = 3 - 3 = 0 Р = 4,579 мм рт. ст. t= 0,0076 0 С ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНЫХ СИСТЕМ Диаграммы состояния двухкомпонентных систем - состав-свойство - получаются методом физико-химического анализа - изучение зависимости состава системы от ее физических свойств. Изучение диаграмм состояния позволяет выяснить характер взаимодействия компонентов системы, а также судить о химическом составе и границах существования фаз. Для построения диаграмм состояния пользуются методом термического анализа - получение зависимости температуры системы от времени. На кривой нагревания отмечают изломы и площадки, соответствующие температуре плавления и наносят их на диаграмму. Поскольку Р = const С = К + 1 - Ф = 2 + 1 - Ф = 3 - Ф
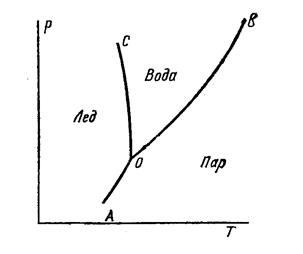
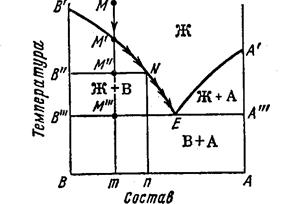
СИСТЕМА С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ
2.6.2 СИСТЕМА С ПОЛНОЙ НЕРАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ
в т. Е С = 3 - 3 = 0
ПРАВИЛО РЫЧАГА - отношение компонентов равновесных фаз обратно отношению отрезков,отсекаемых ординатой температуры на участке смеси,лежащей внутри области двухфазного равновесия.
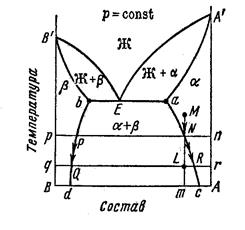
СИСТЕМА С ОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ
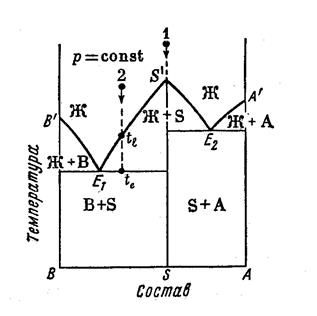
2.6.4 СИСТЕМА С ОБРАЗОВАНИЕМ ХИМИЧЕСКОГО СОЕДИНЕНИЯ
ТРЕХКОМПОНЕНТНЫЕ СИСТЕМЫ
С = 3 + 1 - Ф = 4 - Ф Из этого уравнения видно, что максимальная вариантность системы равна трем, следовательно, для изображения диаграммы состояния надо откладывать по координатным осям температуру и две концентрации (концентрация третьего компонента является независимой переменной).В изобарной диаграмме состояния координаты состава лежат в горизонтальной плоскости, а по вертикали откладывают температуру.
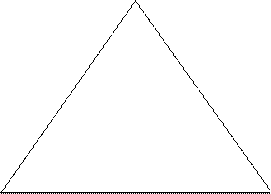
Для построения диаграммы состояния тройной системы важное значение имеет способ изображения состава. Состав трехкомпонентной системы удобно изображать, пользуясь треугольником Гиббса-Розебома.
В
20 80
80 20 А С 20 40 60 80
Вершины равностороннего треугольника отвечают содержанию в системе 100% каждого из компонентов А, В и С. Стороны треугольника позволяют описать составы двухкомпонентных систем А + В, В + С, С + А. Точки, лежащие внутри треугольника, описывают состав трехкомпонентных систем. Метод определения состава, предложенный Гиббсом, основан на том, что сумма перпендикуляров, опущенных из любой точки внутри равностороннего треугольника на каждую из сторон, равна высоте треугольника. Если принять, что длина всей высоты треугольника отвечает 100%, то состав тройной фазы можно выразить с помощью длин вышеупомянутых перпендикуляров. При этом содержанию данного компонента будет отвечать длина перпендикуляра, опущенного на сторону, противоположную соответствующей вершине треугольника. Длина перпендикуляров оценивается с помощью сетки, покрывающей треугольник. Розебом предложил для определения состава системы использовать отрезки трех прямых, параллельных сторонам треугольника и проходящей от данной точки до пересечения с каждой из сторон треугольника. Изобразим простейшую диаграмму состояния трехкомпонентной системы, основанием которой служит треугольник Гиббса, а на перпендикулярах откладываются температуры фазовых превращений.
РАСТВОРЫ ХАРАКТЕРИСТИКА РАСТВОРОВ
Растворы широко распространены в природе и имеют важное значение в химической технологии. С молекулярно-кинетической точки зрения раствор - гомогенная смесь, состоящая из нескольких веществ, находящихся в стадии молекулярного раздробления. С точки зрения правила фаз раствором называется двух или многокомпонентная гомогенная часть системы, состав которой может произвольно меняться в границах, определяемой растворимостью веществ. В этих определениях подчеркивается два основных признака раствора - его гомогенность и переменность состава.
Растворы отличаются от химических соединений также характером и величинами энергии связи между частицами. Химическое соединение образуется за счет мощных валентных связей (130 – 630 (кдж/моль), а раствор, главным образом, за счет гораздо более слабого межмолекулярного взаимодействия (2 - 40 кдж/моль). В зависимости от агрегатного состояния различают следующие типы истинных растворов: 1. Г + Г (воздух) 2. Г + Ж (р-р кислорода в воде) 3. Г + Т (р-р водорода в платине) 4. Ж + Ж (р-р глицерина в воде) 5. Ж + Т (р-р канифоли в спирте) 6. Т + Т (металлические сплавы) Важнейшей характеристикой раствора является его концентрация. 1.Массовая доля, % gi = 2. Объемная доля, % ji = 3.Молярность, моль/л - количество молей i - того компонента на 1 литр раствора. ci = 4.Моляльность, количество молей i- того компонента в 1000 г. растворителя. mi = 5.Нормальность, г-экв/л, количество г-эквивалентов на 1 литр раствора. CN = 6. Мольная доля - отношение числа молей данного компонента к общему числу молей всех компонентов в растворе. Ni =
ЗАКОН РАУЛЯ
Давление пара вещества над раствором равно давлению пара чистого вещества, умноженному на его мольную долю в растворе. m = mпо + RTlnPi m = mжо + RTlnNi dm = RTdlnPi dm = RTdlnNi dlnPi = dlnNi ln P1 = P10N1
1 - P10 -
Относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего вещества в летучем растворителе, независимо от природы растворителя и температуры, равно мольной доле растворенного вещества.
3.3 ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ И ПОВЫШЕНИЕ
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 214; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.3.235 (0.01 с.) |


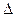 S dT = DV dP
S dT = DV dP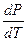 =
= 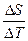
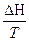 =
= 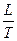
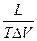
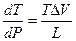
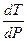 =
= 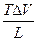


 T
T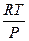
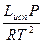 2
2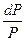 = Lисп
= Lисп 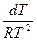
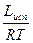 + const
+ const
 P
P

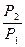 = DH/R (
= DH/R (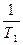 -
- 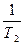 )
)
 40 60
40 60














 60 40
60 40
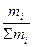 i 100
i 100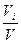 100
100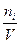 =
= 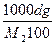
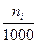 =
= 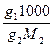
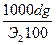
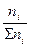 =
= 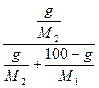
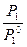 = lnN1
= lnN1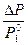 = N2
= N2


