
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение первого закона термодинамики к процессам в любых системахСодержание книги
Поиск на нашем сайте
1.Изохорный процесс V = const dV = 0 dQ = dU + PdV dQv = dU Qv = DU 2.Изобарный процесс P = const dQp = dU + PdV = dU + d(PV) = d(U + PV) = dH δQp = dH Qp = DH H = U + PV - энтальпия 3.Изотермический процесс T = const U = f(T) U = const dU = 0 dW = PdV Q = W PV = RT P = Q = W = 4.Адиабатный процесс Q = 0 DW = -dU W = -DU = U1 – U2 т.е. работа в адиабатической системе совершается за счет убыли внутренней энергии.
1.4 ТЕРМОХИМИЯ. ЗАКОН ГЕССА
Tермохимия - раздел химии, занимающийся изучением теплот химических реакций, фазовых превращений и др. процессов. Эти данные широко используются при расчетах тепловых балансов процессов и для расчета химического равновесия. Тепловой эффект химической реакции - теплота, сопровождающая реакцию, при условиях одинаковой температуры исходных веществ и продуктов реакции. Различают Qр = DH и Qv = DU Qp = Qv + DnRT Реакции с выделением теплоты называют экзотермическими DН < 0 Qр>0 Реакции с поглощением теплоты называют эндотермическими DH > 0 Qp<0 При написании термохимических уравнений реакции указывают агрегатное состояние реагентов и тепловой эффект реакции. За стандартное состояние принимают состояние абсолютно чистого вещества находящегося при 298°С и при давлении 0,1013 МПа (1атм). Закон Гесса (1836г.) - если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т. е. тепловой эффект химической реакции зависит только от начального и конечного состояний системы, но не зависит от пути перехода. Большое практическое значение имеют расчеты тепловых эффектов химических реакций по теплотам образования и сгорания, которые можно найти в справочнике. Теплота образования вещества - это тепловой эффект образования данного вещества из простых веществ, находящихся в наиболее термодинамически устойчивом состоянии. Обозначается DHf,2980 Ca(т) + С(т) + 3/2 О2 = СаСО3(т) +DН0f.298 Первое следствие из закона Гесса - тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. n1A1 + n2A2 = n3A3 + n4A4 + DHx DHx = n3DHfA3 +n4DHfA4 - n1DHfA1 - n2DHfA2 Теплота сгорания вещества - количество теплоты, которое выделяется при полном сгорании одного моля вещества до высших окислов при данных условиях.
С6Н6 + 15/2O2 = 6CO2 + 3Н2О + DНС Второе следствие из закона Гесса - тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции DHx = n1DHcА1 + n2DHcА2 - n3DHcА3 -n4DHcА4
1.5 ПРИБЛИЖЕННЫЕ МЕТОДЫ РАСЧЕТА ТЕПЛОТ ОБРАЗОВАНИЯ И СГОРАНИЯ
1.По энергии разрыва связей DHf = S(nieI)исх + nQCвозг - S(nieI)кон где e - энергия разрыва связей,QCвозг - теплота возгонки углерода 2.Эмпирическая формула расчета теплоты сгорания органического соединения в газообразном состоянии DHc298 = - (204,2 n + 44,4 m + Σx) кдж/моль, где n - число атомов кислорода, необходимое для полного сгорания вещества m - число молей образующейся воды Σх - поправка (термическая характериcтика), которая находится по справочнику для различных гомологических рядов 3.Метод тепловых поправок Расчет строится на основе значений DН0f298 для веществ, лежащих в основе соответствующего гомологического ряда. В эти основные величины вводят поправки на увеличение углеродной цепи, замещение простых связей сложными и т.д. Порядок расчета 1.Выбирают основное вещество, из которого минимальным числом замещений можно получить структурную формулу соединения. Находят DНf 298 основного вещества. 2.Последовательным введением в основное вещество групп –СН3 строят углеродный скелет рассматриваемого соединения, при этом на каждую группу - СН3 вносят поправки в основную величину DНf 298. 3.После построения углеродного скелета соединения замещают простые связи сложными и вводят соответствующие поправки. 4.Замещают группировки –СН3 другими группами и вводят соответствующие поправки.
1.6 ТЕПЛОЕМКОСТЬ. СВЯЗЬ ТЕПЛОЕМКОСТИ С ТЕРМОДИНАМИЧЕСКИМИ ФУНКЦИЯМИ
Теплоемкостью называют количество теплоты, необходимое для нагревания единицы массы вещества на 1 К. Различают удельную и молярную теплоемкости. Также различают истинную и среднюю теплоемкости. Средней молярной теплоемкостью называют отношение количества теплоты, подведенного к одному молю вещества, к разности температур (Т2 – Т1). С = Истинной молярной теплоемкостью называют отношение бесконечно малого количества теплоты, которое нужно подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается
. C = Q = С = CV = DU = DU = CV (T2 – T1) CP= DH = DH = CP(T2 –T1) В расчетах Ср определяют по опытным данным для Сv и наоборот. Для этого нужно знать разность теплоемкостей (Cp – Cv). Cp - Cv = Теплоемкость вещества лишь в сравнительно узком интервале температур можно считать независимой от температуры. Вообще говоря, теплоемкость есть сложная функция от температуры и может быть рассчитана лишь квантовомеханически. Практически зависимость теплоемкости выражается с помощью ряда, коэффициенты которого определяются опытным путем. Ср = а + вТ + с Т2 СV = а + вТ + с`Т-2
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 241; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.140.108 (0.007 с.) |


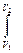 PdV =
PdV =  = RTln
= RTln 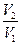 = RTln
= RTln 


 =
= 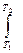 C dT
C dT
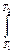 CdT
CdT =
= 
 =
= 
 -
- 


