
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Распространение волнового уравнения наСодержание книги
Поиск на нашем сайте
ДРУГИЕ АТОМЫ Выше рассматривались орбитали атома водорода. В более сложных атомах на электрон влияют не только ядро, но и все остальные электроны; это создает дополнительное осложнение, чрезвычайно затрудняющее точное решение волнового уравнения. Были предложены два способа приближенного решения. Один из них, разработанный Д. Р. Хартри и У. Г. Хартри и модифицированный В. А. Фоком, называется методом самосогласованного поля, другой метод, предложенный Слейтером, приводит к так называемым слейтеровским орбиталям. В методе самосогласованного поля упрощение проблемы достигается за счет предположения, что каждый отдельный электрон движется в сферически симметричном силовом поле, создаваемом ядром, и усредненном поле, обусловленном всеми остальными электронами. Расчеты по этому методу довольно сложны и трудоемки. Во втором методе, разработанном Слейтером, предполагается, что электрон находится в центральном поле, обусловленном эффективным ядерным зарядом. Слейтеровские орбитали имеют в общем такой же вид, как и орбитали, приведенные выше, так как введение эффективного ядерного заряда изменяет только радиальную часть волновой функции, но они отличаются от орбиталей атома водорода отсутствием радиальных узлов. Поскольку внутренние электроны не всегда достаточно эффективно экранируют внешние электроны, относительные энергии орбиталей изменяются в зависимости от ядра атома. Для большинства атомов периодической системы можно пользоваться следующим рядом изменения энергий по орбиталям: ls<2s<2p<3s<Зр< 4s <3d<4p<5s<4d<5p<6s<4f<5d<6p<7s. При описании строения атомов разных элементов с использованием символов s, p, d и f следует просто добавлять 2, 6, 10 и 14 электронов соответственно на s-, p-, d- и f-орбитали. Сперва заполняются орбитали с более низкой энергией. В таком описании строения атомов используются два квантовых числа n и l. Более полно можно описать состояние электронов в атомах, используя все четыре квантовых числа n, l, miи s. Одним из способов включения всех четырех квантовых чисел является использование квантовых ячеек. Обычно рассматриваются только валентные электроны. s-Орбитали обозначаются одной ячейкой; р-орбитали—тремя ячейками, по одной для рx, pz и рy d-орбитали — пятью ячейками по одной для dx-y, dxz, dyz, dz и dxy, а f-орбитали—семью ячейками. Спиновое квантовое число +1/2 обозначается символом , а -1/2 — символом ¯. Для изображения конфигураций атомов с помощью ячеек, помимо описанных обозначений, нужно учитывать еще два правила: 1) Принцип исключения Паули: в атомах не может быть двух электронов, у которых все четыре квантовых числа одинаковы. 2) Правило Гунда: электроны располагаются на вырожденных орбиталях таким образом, чтобы сохранялось наибольшее возможное число параллельных спинов, т. е. электроны стремятся не образовывать пары, если имеется возможность избежать этого.
АТОМНЫЕ ТЕРМЫ
Дополнительным осложнением, с которым сталкиваются в случае многоэлектронных систем, является большое число способов расположения электронов на данных орбиталях. Некоторые из способов расположения двух электронов на р-орбиталях приведены ниже
Среди них имеются более высокие энергетические состояния атома, а отдельные комбинации могут оказаться вырожденными. Дело в том, что при разных расположениях электронов межэлектронные взаимодействия различны; межэлектронное отталкивание для двух электронов на одной и той же орбитали больше, чем для двух электронов на разных орбиталях. Из-за отличий в межэлектронных взаимодействиях (которых нет в системе с одним электроном) в случае многоэлектронных систем возможно гораздо больше вырожденных состояний, чем при наличии только одного электрона. Далее в многоэлектронных системах теряют смысл понятия спинового и орбитального угловых моментов индивидуальных электронов. Эти свойства отдельных электронов объединяются с образованием одного результирующего углового момента всего многоэлектронного атома. Этот результирующий момент обозначается буквой J Для определения J можно пользоваться двумя схемами, описывающими взаимодействие всех угловых моментов в атоме. Они называются схемой L.S-взаимодействия (или схемой Рассела — Саундерса) и схемой j-j взаимодействия. Схема L.S-взаимодействия используется в тех случаях, когда спин-орбитальные взаимодействия сравнительно слабы. При этом отдельные орбитальные угловые моменты электронов взаимодействуют с образованием результирующего углового момента, который связан с квантовым числом L, характеризующим расстояние атома в целом. Спиновые моменты отдельных электронов также взаимодействуют с образованием результирующего спинового момента, описываемого квантовым числом S. Значения L и S определяют значение квантового числа J — суммарного углового момента, который может принимать квантованные положительные значения от |L—S| до |L+S| (последовательные значения, отличающиеся на 1). Прямыми скобками обозначаются абсолютные значения |L—S| (т. е. истинный знак не существен и J³0). Схема L-S-взаимодействия пригодна для всех атомов с небольшими атомными номерами (Z<130). Если спин-орбитальное взаимодействие велико, используется схема /j-j/-взаимодействия. При этом спиновые угловые моменты отдельных электронов сперва комбинируются с их орбитальными угловыми моментами с образованием суммарного углового момента j для отдельных электронов, а отдельные j взаимодействуют с образованием результирующего J всего атома. Можно теперь суммировать правила определения символа терма основного состояния атома в рамках схемы L-S взаимодействия: 1. Мультиплетность по спину (S) должна быть максимальной, т. е. электроны должны занимать вырожденные орбитали так, чтобы их спины оставались по возможности параллельными (правило Гунда). 2. Орбитальный угловой момент (L) должен быть максимальным, т. е. сперва должны заполняться орбитали с наибольшими положительными значениями m. 3. Если подоболочка заполнена более чем наполовину, то основным является состояние с наибольшим J, а если подоболочка заполнена менее чем наполовину, то — с наименьшим J. Лучше всего продемонстрировать правила определения символа терма основного состояния (в предположении схемы LS - взаимодействия) на каком-либо примере. Распределение электронов по квантовым ячейкам для атома углерода имеет вид
и символом терма будет ЗPo. Значение квантового числа L можно найти, складывая ml; для всех электронов на неполностью занятых орбиталях. Так, например, для атома углерода L=+1+0=1. Квантовое число l для отдельного электрона можно рассматривать как вектор с компонентой ml в направлении приложенного поля. Суммарный вектор L будет иметь максимальную компоненту, равную сумме отдельных компонент ml. Значение квантового числа S равно сумме спиновых квантовых чисел - (ms=±1/2} для каждого неспаренного электрона, так что для углерода S=1/2+1/2=1 (используются абсолютные значения L и S ). Заполненные подоболочки не вносят вклада в- L или S, поскольку суммы значений ml; и ms для одной заполненной s-орбитали, трех заполненных р-орбиталей или пяти заполненных d-орбиталей равны нулю. Значение L указывается в символе терма буквами S, Р, D, F, G, Н для значений L, соответствующих 0, 1,2, 3, 4, 5 и 6 (аналогично использованию букв s, р, d, f и т. д.). Так, буква Р в символе терма атома углерода указывает, что L=1. Число в верхнем левом индексе соответствует спиновой мультиплетности состояния и выражается формулой 2åms + 1, или 2S + 1 Для атома углерода оно равно 3 и соответствует вырождению, возникающему при всех возможных ориентациях полного спинового момента электронов. Поскольку S =1, спиновая мультиплетность равна 3. Значения J - (равные от |L—S| до |L+S| составляют |L — S| = 1—1=0 и |L+S| = =1+1=2, так что J==0, 1, 2 (для заполнения интервала от |L—S| до |L+S| требуется только одно целое число—единица). Если подоболочка заполнена меньше чем наполовину, состоянием с низшей энергией является состояние с минимальным J, а при подоболочке, заполненной больше чем наполовину: низшей энергии соответствует максимальное значение J. Для подоболочки, заполненной точно наполовину, возможно только одно значение J, так как L при этом равно нулю: |L+.S|= ==|0+S|=|L—S|=|0—S|=S. Поскольку у атома углерода имеются только два электрона при наличии в p-подоболочке шести мест, низшее значение J==0 отвечает минимальной энергии Поэтому символ терма основного состояния атома углерода имеет вид ЗP0. У V3+ расположение электронов в основном состоянии может быть представлено как
с символом терма3F2 (L=3, S=1; J=4, 3, 2). Возбужденное состояние для этого иона имеет вид Для атома азота со схемой расположения электронов по ячейкам L=0, S=3/2, J=3/2, откуда следует символ терма 4S3/2. Отметим, что в этом случае возможно только одно значение J с L= 0 для |L+S|= |L—S| =3/2.
5. Химическая связь
Существуют пять типов химической связи 1.Ионная 2.Ковалентная 3.Межмолекулярная(связь обусловленная силами Ван-дер-Ваальса) 4.Водородная 5.Металлическая
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |




 . Для указания электронной конфигурации и результирующего углового момента атомного состояния используются символы термов.
. Для указания электронной конфигурации и результирующего углового момента атомного состояния используются символы термов.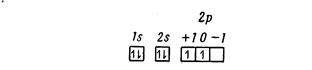

 с символом терма 1G4 {L=4, S=0, J=4). Вследствие межэлeктронных взаимодействий энергии этих и многих других состояний V3+ отличаются друг от друга.
с символом терма 1G4 {L=4, S=0, J=4). Вследствие межэлeктронных взаимодействий энергии этих и многих других состояний V3+ отличаются друг от друга.


