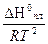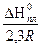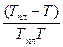Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика концентрированныхСодержание книги
Поиск на нашем сайте
РАСТВОРОВ. АКТИВНОСТЬ
Активность можно определить как величину, характерную для реального раствора, которую подставляют вместо концентрации в уравнение для химического потенциала идеального раствора. mI = mi0 + RTln ai Активность называется эффективной или действующей концентрацией. Ввел это понятие Льюис. Рассмотрим химический потенциал компонента в растворе и насыщенном паре над этим раствором. В растворе mi = mi0 + RTln ai в паре mi = mi0n + RTln Pi для чистого компонента в паре mi0 = mi0n + RTlnPi 0 компонуя уравнения получим ai = т.е. активность компонента равна отношению давления его пара над раствором к давлению пара над чистым раствором более строго ai = Важной характеристикой раствора является коэффициент активности. Для идеального раствора mИД = mi0 + RTln Ni для реального раствора mi = mi0 + RTln ai mI - mид = RTln g = Коэффициент активности характеризует работу или изменение химического потенциала при переходе компонента из идеального раствора в реальный. Очень важен вопрос о выборе стандартного состояния. Для растворов часто принимают стандартным такое состояние, чтобы для предельно разбавленных растворов g = 1. В том случае, когда активность определяется через мольные доли коэффициент активности называется рациональным. Если концентрация выражается в молях на литр, то коэффициент активности называется практическим.
3.9 РАСТВОРИМОСТЬ ГАЗОВ В ЖИДКОСТЯХ. ЗАКОН ГЕНРИ
Растворы газов в жидкостях можно рассматривать как системы, в которых устанавливается равновесие между жидкой фазой, содержащей растворитель и растворенный газ, и газовой фазой, содержащий данный газ и пары растворителя. Растворимость вещества определяется его концентрацией в насыщенном растворе. Растворимость газов в жидкостях зависит от природы растворяемого газа и растворителя, давления газа, температуры и присутствия в растворе различных веществ, особенно электролитов. Растворимость газов в жидкость помимо обычной концентрации выражается еще коэффициентом растворимости a или коэффициентом поглощения b. Коэффициент растворимости равен объему газа, выраженному в м3 и растворенному в 1 м3 растворителя при данной температуре и 1 атм. Коэффициент поглощения равен объему газа, растворенному в 1 м3 при 0° С и 1 атм. b = a 273,15/Т.
Если газ химически не взаимодействует с растворителем, то зависимость растворимости газа в жидкости от давления выражается законом Генри: Парциальное давление пара растворенного газа пропорциональнo его мольной доле в растворе mi = mi0n +. RTlnPj mi = miож + RTlnNj In Pi = kNj Закон Генри справедлив только тогда, когда растворение газа в жидкости не связано с процессами диссоциации и ассоциации молекул растворенного газа. В присутствии электролитов растворимость газов в жидкостях уменьшается. Влияние электролитов на растворимость газов в водных растворах описывается уравнением Сеченова lg где N0 и N растворимость газа в воде и растворе электролита, к - постоянная, характерная для данного электролита, С - концентрация электролита. Уменьшение растворимости газов в присутствии солей называется высаливанием.
3.10 РАСТВОРИМОСТЬ ТВЕРДЫХ ТЕЛ В ЖИДКОСТЯХ
Растворимость твердых тел в жидкостях сильно зависит от их природы, природы растворителя и температуры. Вопрос о зависимости растворимости от физико-химических свойств компонентов находится сейчас в неудовлетворительном состоянии, что связано с отсутствием ясных и общих представлений о молекулярных силах, действующих в растворах и определяющих растворимость, и с отсутствием универсальной теории жидкостей. Если, однако, при растворении образуется идеальный раствор, величина растворимости может быть предсказана термодинамически ( где N2 - растворимость твердого тела, DHраст - дифференциальная теплота растворения. Растворимость твердого вещества в растворе можно представить протекающим в две стадии: 1) Плавление твердого. 2) Смешение жидкого вещества с идеальным раствором. В случае идеального раствора теплота второго процесса равна нулю. Это значит, что DН0пл = DНраст ( lgN2 = -
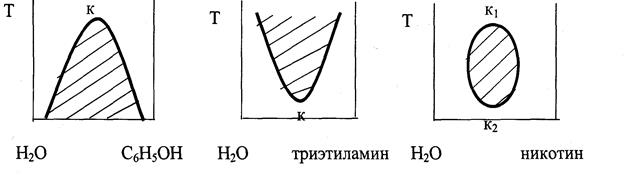
3.11 ОГРАНИЧЕННАЯ ВЗАИМНАЯ РАСТВОРИМОСТЬ ЖИДКОСТЕЙ Ограниченная взаимная растворимость двух жидкостей наблюдается в системах со значительным отклонением от идеальности. Такая растворимость зависит от температуры, однако влияние температуры на разные системы различно. В одних системах взаимная растворимость увеличивается с ростом температуры, а в других уменьшается. Температура, выше или ниже которой компоненты образуют гомогенный раствор во всех соотношениях, называется критической температурой растворения.
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 210; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.116.142 (0.007 с.) |

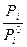
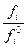
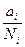
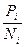 =
= 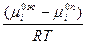 = Ink
= Ink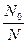 = kC,
= kC,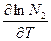 )р =
)р = 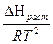
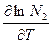 )p =
)p =