
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Флюсы, используемые при паянииСодержание книги
Поиск на нашем сайте В электротехнике, во избежание коррозии в месте пайки и образования защитной «ванны» от воздействия окружающей среды используются препараты – флюсы (Табл.102, 103). Флюсы, используемые при паянии Таблица 102
Рекомендуемые флюсы Таблица 103
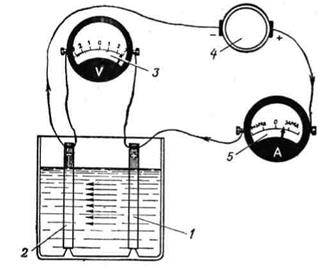
Электролиты для аккумуляторных батарей. Общие сведения о стартерных аккумуляторных батареях (АКБ) Аккумулятор - это обратимый химический источник энергии, способный накапливать электрическую энергию и отдавать ее потребителям. Электрохимические процессы, происходящие в свинцово-кислых аккумуляторах, заключаются в следующем. Под действием постоянного электрического тока, протекающего через пластины и электролит, аккумулятор заряжается (рис. 29). При этом образовавшийся на пластинах сульфат свинца превращается на положительной пластине в двуокись свинца, а на отрицательной - в металлический губчатый свинец. Освободившиеся ионы сульфата свинца, вступая в реакцию с ионами водорода, образуют серную кислоту. Плотность электролита повышается. В конце заряда, когда сульфат свинца на положительной пластине почти полностью перейдет в двуокись свинца, а на отрицательной пластине - в губчатый свинец, часть подводимой к батарее электрической энергии будет расходоваться на разложение входящей в состав электролита воды. Этот процесс сопровождается обильным газовыделением, напоминающим «кипение» электролита, и называется процессом электролиза.
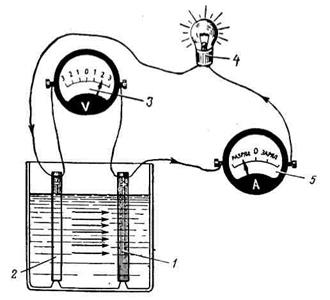
Рис. 29. Путь тока при заряде аккумулятора, состоящего из двух пластин: 1 - положительная пластина; 2 - отрицательная пластина; 3 - вольтметр; 4 – генератор (зарядное устройство); 5 - амперметр. Батарея считается заряженной, если плотность электролита больше не повышается, напряжение каждого аккумулятора становится постоянным и наблюдается обильное газовыделение. Заряженный аккумулятор способен сохранять накопленную электрическую энергию длительное время. При разряде аккумулятора (рис. 30) значительная часть двуокиси свинца - на положительной и губчатого свинца - на отрицательной пластинах превращается в сульфат свинца. Процесс образования сульфата свинца при разряде аккумулятора сопровождается понижением плотности электролита. Химические реакции, протекающие при разряде и заряде аккумуляторов, называются реакциями электролиза. Их можно представить таким образом: До разряда После разряда
Рис. 30. Путь тока при разряде аккумулятора, состоящего из двух пластин: 1 - положительная пластина; 2 - отрицательная пластина; 3 - вольтметр; 4 - потребитель тока; 5 - амперметр Количество электрической энергии, которое может накопить и отдать аккумулятор, зависит: –от количества активной массы, участвующей в электрической реакции; –температуры электролита; –величины разрядного тока; –времени протекания разряда. Основными величинами, которые характеризуют свойства аккумуляторной батареи, являются: электродвижущая сила (ЭДС); напряжение аккумуляторной батареи (АКБ); емкость аккумуляторной батареи. ЭДС при этом представляет собой алгебраическую разность этих потенциалов, и в основном она зависит от плотности электролита, находящегося в данный момент в аккумуляторе. Величина электродвижущей силы в аккумуляторе может быть определена по эмпирической формуле
где Е а - ЭДС аккумулятора; ρ - плотность электролита (при 15 °С в аккумуляторе). В отличие от напряжения электродвижущая сила измеряется вольтметром при разомкнутой внешней цепи, т. е. без тока нагрузки. Практически ЭДС измеряется для обнаружения короткого замыкания между пластинами. При неполном коротком замыкании ЭДС аккумулятора будет ниже, чем в исправном аккумуляторе, а при полном коротком замыкании ЭДС становится равной нулю. Напряжение АКБ - это разность потенциалов положительных и отрицательных пластин при прохождении тока через аккумуляторную батарею. Напряжение аккумулятора определяется по формуле
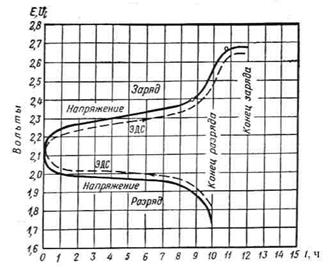
где U a - напряжение аккумулятора; Е а - ЭДС аккумулятора; Ιr. - величина внутреннего падения напряжения; r - внутреннее сопротивление аккумулятора в омах. При включении батареи для заряда вначале наблюдается резкое увеличение напряжения (при поддержании постоянной величины зарядного тока) [16]. В дальнейшем в процессе заряда напряжение на аккумуляторе плавно повышается только до 2,4 В, а затем в конце заряда, когда часть электрической энергии начинает расходоваться на разложение воды, напряжение резко возрастает до 2,65÷2,78 В, после чего остается неизменным. Когда напряжение становится постоянным - это один из признаков окончания заряда (рис. 31).
Рис. 31. Зависимость напряжения аккумулятора от продолжительности заряда и разряда При включении батареи на разряд в первый момент наблюдается незначительное уменьшение напряжения. В дальнейшем, в течение большей части разряда, напряжение падает медленно, а в конце разряда быстро снижается, так как наступает полный разряд аккумулятора. Разряжать батарею ниже допустимого предела (1,7 В) нельзя, потому что ранее разрядившийся аккумулятор начнет переполюсовываться, а это приведет к разрушению активной массы пластин. Поэтому для каждого режима разряда определена величина конечного разрядного напряжения. Емкостью аккумуляторной батареи называется количество электричества, которое отдает полностью заряженная аккумуляторная батарея при непрерывном разряде ее током постоянной величины до допустимого наименьшего напряжения (1,7 В), соответствующего установленному разрядному току. Емкость АКБ измеряется в ампер-часах и определяется как произведение величины разрядного тока (в амперах) на время разряда (в часах). Поскольку емкость батареи зависит от разрядного тока
Рис. 32. Зависимость емкости аккумуляторной батареи 6-СТЭН-140М от величины разрядного тока [16]. С увеличением разрядного тока емкость свинцово-кислотных аккумуляторов уменьшается. Это объясняется тем, что при большем разрядном токе увеличивается расход находящейся в порах пластины серной кислоты (H 2 S0 4), а скорость проникновения (диффузии) ее недостаточна, чтобы покрыть этот расход. Кроме того, при разряде большими токами образуется сульфат свинца PbS0 4 (в основном, в порах у поверхности пластин). Этот сульфат уменьшает сечение пор и ухудшает диффузию серной кислоты. При снижении разрядного тока напряжение аккумулятора восстанавливается и аккумулятор может отдать еще дополнительную емкость. Например, АКБ-6-СТЭН-140М, разряженная до допустимого предела током 420 А, при длительном разряде током 12,6 А может отдать еще 60÷70 А·ч.
Таким образом, на каждый градус снижения температуры электролита, начиная с температуры 30 °С, емкость АКБ уменьшается на 1 %.
Рис. 33. Зависимость емкости аккумуляторных батарей от температуры электролита при различных величинах разрядного тока (для аккумуляторной батареи 6-СТЭН-140М) [16]. Так как номинальная емкость батарей гарантируется заводами-изготовителями при температуре электролита 30 °С, то емкость, которую батарея отдает, необходимо для сравнения с номинальной приводить к емкости при 30 °С. Приведенная емкость определяется по формуле [16]:
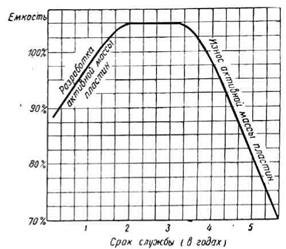
где С пр - емкость, А·ч, приведенная к 30 °С; С факт - фактическая полученная емкость, А·ч; Т ср - средняя температура электролита при разряде. В процессе эксплуатации АКБ емкость постоянной не остается. В начале эксплуатации она возрастает, так как разрабатывается активная масса пластин. Затем некоторое время она держится стабильной, а к концу срока службы батареи постепенно уменьшается (рис. 34). Когда емкость АКБ уменьшается до 50 %, ее электрическая характеристика ухудшается настолько, что батарея становится непригодной к дальнейшей эксплуатации. Уменьшение емкости АКБ объясняется следующими процессами, которые происходят внутри батареи: разбуханием и оплыванием активной массы пластин, в результате чего происходит необратимая сульфация положительных пластин;
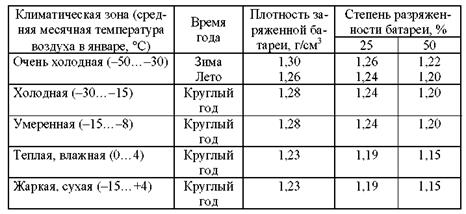
Рис. 34. Зависимость емкости аккумуляторных батарей 6-СТЭН-140М от срока службы (в годах) усадкой активной массы и необратимой сульфацией отрицательных пластин [16]. При малоинтенсивной эксплуатации, исправном электрооборудовании автомобиля, правильном и своевременном обслуживании батареи эксплуатационный (амортизационный) срок ее службы может превышать гарантийный. 15. 2. Приготовление электролитов и эксплуатационные требования к ним Плотность электролита для АКБ зависит от климата района, в котором эксплуатируется автомобиль (табл. 104). Нормы плотности электролита при температуре 25 °С [16] Таблица 104
Электролитом в свинцово-кислотных АКБ служит раствор серной аккумуляторной кислоты в дистиллированной воде. Для приготовления электролита применяется аккумуляторная кислота плотностью 1,83÷1,84 (ГОСТ 667) с допустимыми примесями (табл. 105). Аккумуляторная серная кислота представляет собой маслянистую прозрачную жидкость, которую подразделяют на два сорта - А и Б, в зависимости от количества примесей в ней. Содержание серной кислоты в сортах А и Б должно быть в пределах 92÷ 94 %. Аккумуляторную серную кислоту обычно разливают в стеклянные бутылки емкостью 20÷30 л. Бутылки помещают в ивовые корзины или прочные деревянные обрешетки, доходящие до горла бутылки. Количество допустимых примесей в аккумуляторной серной кислоте [16] Таблица 105
Готовить электролит непосредственно из кислоты не следует, такой электролит будет сильно разогреваться. Для заливки в аккумуляторы следует готовить электролит из ранее приготовленного раствора плотностью 1,40 г/см3, для расчета количества воды и кислоты, чтобы получить требуемую плотность, следует пользоваться данными табл. 106. При приготовлении электролитов, во избежание ожогов кожи, глаз и отравления, необходимо соблюдать правила техники безопасности: •хранить кислоту в полиэтиленовых баках с плотными крышками или в стеклянных бутылях с притертыми пробками; •переносить бутылки с кислотой, а также переливать кислоту из бутылей обязательно нужно вдвоем, в одиночку это делать категорически запрещено; •не проливать кислоту на пол; •пролитую кислоту вытирают тряпкой, смоченной в растворе едкого калия или кальцинированной соды; •готовить электролит необходимо в эбонитовой, фаянсовой, керамической или выложенной свинцовыми листами деревянной посуде, так как другая посуда, в том числе и стеклянная, для этого непригодна из-за того, что стекло может лопнуть от высокой температуры, которая возникает при вливании кислоты в воду; •категорически запрещено вливать воду в кислоту, так как вода, влитая в кислоту, быстро нагревается, вскипает и разбрызгивается вместе с кислотой;
•при приготовлении, заливке и доливке электролита необходимо надевать защитные очки, кислотощелочестойкие перчатки, брезентовые нарукавники, прорезиненный фартук и резиновые сапоги (рис. 35); •при попадании серной кислоты на кожу необходимо немедленно, до оказания медицинской помощи в течение 5... 10 минут промыть пораженные места обильной струей воды и смочить 10%-ным водным раствором нашатырного спирта или кальцинированной (бельевой) соды; •при попадании серной кислоты в глаза следует немедленно промыть их обильным количеством воды, а затем слабым раствором питьевой соды; в случае отравления серной кислотой в качестве нейтрализующего вещества необходимо применять молоко или питьевую соду. Количество дистиллированной воды, электролита плотностью 1,40 г/см3 при 15 °С или кислоты плотностью 1,83 г/см3 при 15 °С, необходимое для приготовления 1 л электролита требуемой плотности Таблица 106
Примечание. В результате химической реакции объем приготовленного электролита получается меньше, чем сумма объемов компонентов, участвующих в реакции. Пример. Требуется приготовить из кислоты 32 л электролита плотностью 1,27 г/см3 (при температуре 15 °С). Метод расчета. По табл. 106 находим, что для приготовления 1 л электролита плотностью 1,27 г/см3 при 15 °С требуются 0,778 л воды и 0,269 л кислоты. Для 32 л электролита воды и кислоты потребуется в 32 раза больше, т. е. воды должно быть 0,778 · 32 = 24,896 л, кислоты 0,269 · 32 = 8,608 л.
Рис. 35. Средства защиты, применяемые при работе с кислотой и аккумуляторными батареями: 1 -резиновые сапоги; 2- 10%-ныйраствор нашатырного спирта; 3 -холодная вода; 4 - 10%-ный раствор кальцинированной (бельевой) соды; 5 - защитные очки с темными стеклами; 6- защитные очки со светлыми стеклами; 7 - прорезиненный фартук; 8 - кислотощелочестойкие перчатки; 9 - брезентовые нарукавники При приготовлении электролитов запрещается применять техническую серную кислоту вследствие того, что в ней содержатся примеси, разрушающие пластины и снижающие срок службы АКБ. Также запрещается применять для приготовления электролита недистиллированную воду, так как речная, озерная, колодезная, ключевая или водопроводная вода всегда содержит различные примеси (хлор, железо и т. п.). Если смешать аккумуляторную кислоту с такой водой, то электролит загрязнится вредными примесями и его нельзя будет заливать в батареи, так как это приведет к повышенному саморазряду батареи и разрушению пластин. При обслуживании, а также при отказе аккумуляторной батареи в процессе эксплуатации ее разряженность проверяют измерением плотности электролита с помощью кислотомера (денсиметра) или с помощью ареометра или мензурки (рис. 14). Для измерения плотности и приготовления электролита в узкий стеклянный сосуд наливают (с помощью резиновой груши) электролит и опускают в него ареометр. Деление на шкале ареометра, совпадающее с уровнем электролита, укажет плотность электролита.
Рис. 36. Измерение плотности электролита: 1 - стеклянный цилиндр; 2 - резиновая груша; 3 - резиновая пробка; 4 - эбонитовая трубка; 5 - ареометр; 6 - мензурка
Плотность электролита изменяется в зависимости от температуры окружающего воздуха, поэтому если температура электролита будет отличаться от 25 °С, то к показаниям ареометра прибавляют или отнимают температурную поправку (табл. 107). Температурная поправка на плотность электролита при отклонении от температуры 25 °С [16] Таблица 107
При температуре электролита выше 30 °С поправка прибавляется к фактическому показателю ареометра. Если температура электролита ниже 20 °С, то поправка вычитается. Когда температура электролита находится в пределах 20÷30 °С, поправка на температуру не учитывается. Неправильные результаты при измерении плотности электролита получают в следующих случаях: •уровень электролита в аккумуляторной батарее не соответствует норме; •электролит слишком горячий или холодный (оптимальная температура для замера плотности составляет 15... 27 °С); •сразу после доливки дистиллированной воды, так как необходимо выждать, пока электролит перемешается. Если батарея разряжена, то для этого может потребоваться несколько часов; •после нескольких включений стартера (следует выждать, пока установится равномерная плотность электролита в элементах батареи); •при «кипящем» электролите (необходимо выждать, пока пузырьки в электролите, набранные в стеклянный цилиндр ареометра, поднимутся на поверхность). Если при измерении плотности электролита обнаружится, что она чрезмерно высокая (1,3 г/см3 и выше), то необходимо удалить часть электролита из элемента и вместо нее долить дистиллированной воды, выждать некоторое время, пока электролит перемешается с водой, и затем повторно замерить его плотность. Таким образом, чтобы содержать аккумуляторную батарею (АКБ) в надежном и исправном состоянии, необходимо следить за чистотой электролита, так как применение электролита, загрязненного вредными примесями, ведет к повышенному саморазряду АКБ и разрушению пластин. Так, например, попадание в электролит каких-либо металлов вызывает в АКБ сильный саморазряд и снижает срок ее службы. Все соединения азота (нашатырного спирта) сокращают срок службы пластин: у положительных пластин разрушается решетка, а у отрицательных пластин ускоряется сульфация. При попадании в электролит соляной кислоты и других соединений происходит усиленный саморазряд батарей и разрушение сепараторов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 408; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.011 с.) |


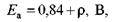
 в
в











 (рис. 32), то в условном обозначении аккумуляторных батарей указывается емкость, соответствующая определенному разрядному режиму. Для автомобильных АКБ за номинальную емкость принимается емкость при 10-часовом режиме разряда. В процессе эксплуатации емкость АКБ зависит: от величины разрядного тока; температуры электролита; плотности электролита; срока службы батареи.
(рис. 32), то в условном обозначении аккумуляторных батарей указывается емкость, соответствующая определенному разрядному режиму. Для автомобильных АКБ за номинальную емкость принимается емкость при 10-часовом режиме разряда. В процессе эксплуатации емкость АКБ зависит: от величины разрядного тока; температуры электролита; плотности электролита; срока службы батареи.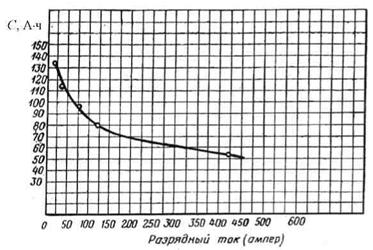



 С понижением температуры емкость батареи уменьшается (рис. 33), так как понижение температуры электролита ведет к увеличению его вязкости и сопротивления. Например, вязкость электролита при 0 °С в два раза больше, чем при 25 °С, а сопротивление электролита при -25 °С в 2 раза больше, чем при 20 °С. Вследствие этого напряжение во время разряда при низкой температуре электролита будет пониженным и батарея разрядится раньше, чем при более высокой температуре, когда электролит имеет меньшие вязкость и сопротивление.
С понижением температуры емкость батареи уменьшается (рис. 33), так как понижение температуры электролита ведет к увеличению его вязкости и сопротивления. Например, вязкость электролита при 0 °С в два раза больше, чем при 25 °С, а сопротивление электролита при -25 °С в 2 раза больше, чем при 20 °С. Вследствие этого напряжение во время разряда при низкой температуре электролита будет пониженным и батарея разрядится раньше, чем при более высокой температуре, когда электролит имеет меньшие вязкость и сопротивление.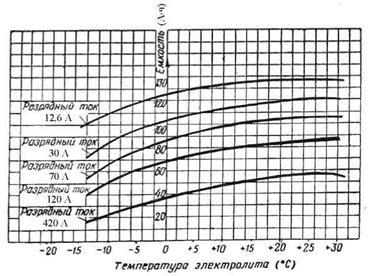












 Снизу и с боков бутылки тщательно обкладывают соломой или древесной стружкой. Отверстия бутылей закрывают притертыми стеклянными пробками. К горлу бутылки подвязывают деревянную бирку, на которой обозначают: наименование завода-изготовителя, название продукта, сорт, дату изготовления, номер, вес брутто и нетто, ГОСТ 667. На каждой корзине должен быть ярлык «Берегись ожога», изготовленный на белой бумаге с синей полосой.
Снизу и с боков бутылки тщательно обкладывают соломой или древесной стружкой. Отверстия бутылей закрывают притертыми стеклянными пробками. К горлу бутылки подвязывают деревянную бирку, на которой обозначают: наименование завода-изготовителя, название продукта, сорт, дату изготовления, номер, вес брутто и нетто, ГОСТ 667. На каждой корзине должен быть ярлык «Берегись ожога», изготовленный на белой бумаге с синей полосой.

 всегда нужно вливать тонкой струйкой кислоту в воду, непрерывно размешивая раствор стеклянной или эбонитовой палочкой;
всегда нужно вливать тонкой струйкой кислоту в воду, непрерывно размешивая раствор стеклянной или эбонитовой палочкой;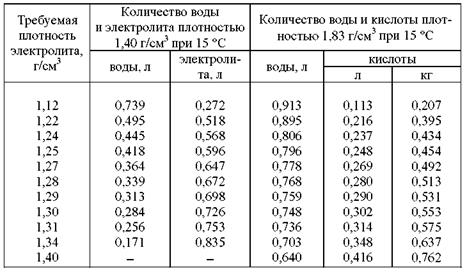

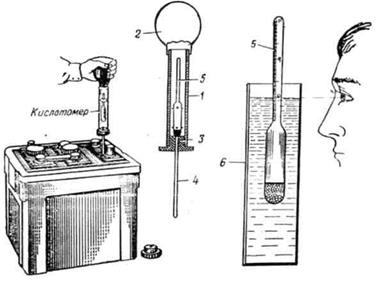
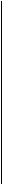




 Для измерения плотности электролита, залитого в аккумулятор, удобнее использовать кислотомер (см. рис. 36). При измерении необходимо следить за тем, чтобы ареометр не «прилипал» к стенкам кислотомера или мензурки, а свободно плавал в электролите. При отсчете показаний ареометра смотреть нужно так, чтобы поверхность электролита была на уровне глаз.
Для измерения плотности электролита, залитого в аккумулятор, удобнее использовать кислотомер (см. рис. 36). При измерении необходимо следить за тем, чтобы ареометр не «прилипал» к стенкам кислотомера или мензурки, а свободно плавал в электролите. При отсчете показаний ареометра смотреть нужно так, чтобы поверхность электролита была на уровне глаз.


