Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Азотной кислот и воды (1:1:1)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Процесс разрушения биологического объекта протекает в 2 стадии:
1. Стадия деструкции, на которой происходит разрушение биологических субстратов организма (белков, жиров, углеводов) на составные части: белки разрушаются до аминокислот, углеводы (полисахариды) до ди- и моносахаридов жиры до глицерина и жирных кислот. Менее всего подвержены разрушению на первой стадии жиры. На первой стадии нагревание не должно быть сильным, чтобы избежать подгорания объекта или сильного пенообразования и выброса частиц объекта из колбы. Поэтому, в начале процесса колбу Къельдаля закрепляют над плиткой на расстоянии 1-2 см. Температура не должна превышать 110°С. Эта стадия непродолжительна по времени, длится от 15 до 40 минут. По окончании деструкции получается прозрачная желтовато-бурая жидкость, иногда с пленкой жира, т.к. на этой стадии все элементы объекта разрушены, кроме жиров.
На стадии деструкции концентрированная H2SO4 выполняет роль водоотнимающего средства, что приводит к нарушению структуры клеток и тканей, деформирует их. При этом она способствует повышению температуры кипения смеси и тем самым повышает окислительное действие концентрированной HNO3.
Роль окислителя на первой стадии выполняет концентрированная HNO3.
Кислота азотная, свободная от окислов азота, что наблюдается в самом начале минерализации, почти инертна. Под влиянием индуцирующих веществ в процессе окисления биоматериала часть кислоты азотной разлагается до кислоты азотистой и оксидов азота, которые являются катализаторами окисления. Под их влиянием и с повышением температуры азотная кислота проявляет себя как сильный окислитель. Идет интенсивный автокаталитический процесс окисления органических веществ:
2. Стадия глубокого жидкофазного окисления. Колбу Къельдаля опускают на плитку и усиливают нагревание. На этой стадии происходит окончательное разрушение органических веществ. Полностью разрушаются и жиры, которые на первой стадии почти не пострадали под действием кислоты азотной. В процессе окисления необходимо по каплям постоянно добавлять в колбу разведенную кислоту азотную из капельной воронки, но при этом скорость добавления реактива должна быть такова, чтобы бурые пары окислов азота, образующиеся при минерализации, не выходили из колбы. Эта стадия длится 3-4 часа и считается законченной тогда, когда:
- начинает выделяться белый туман (пары SО2);
- жидкость остается бесцветной;
-минерализат не темнеет в течение 30 минут без добавления кислоты азотной.
Роль окислителя на этой стадии играет концентрированная кислота серная (её концентрация повышается в смеси до 60-70%, температура превышает 110 °С). Она разлагается с выделением оксида серы (IV) и активного кислорода.
В процессе минерализации происходит не только разрушение органических веществ, но и ряд побочных реакций, имеющих негативное значение:
А) Кислота серная в высоких концентрациях сульфирует органические вещества, а кислота азотная, особенно в присутствии кислоты серной, - нитрует их. Сульфо- и нитросоединения очень прочные, трудно поддаются воздействию окислителей, что влечет за собой неполное разрушение биообъекта. Эти негативные процессы можно значительно уменьшить. Это достигается использованием не концентрированных кислот, а частично разбавленных добавлением в окислительную смесь воды (вспомните соотношение реагентов в окислительной смеси). При разбавлении Н2SO4 и HNO3 водой степень нитрования - сульфирования значительно снижается.
Б) Ещё одна побочная реакция связана с образованием нитрозилсерной кислоты при взаимодействии оксидов азота с концентрированной серной кислотой.
Нитрозилсерная кислота очень устойчива к температуре, однако легко гидролизуется. Реакция гидролиза обратима.
Нитрозилсерная кислота является источником окислителей в минерализате, что мешает в дальнейшем обнаружению некоторых катионов металлов. Чтобы избавиться от негативного воздействия нитрозилсерной кислоты, её удаляют путем проведение денитрации.
Достоинства метода:
1. Сравнительно быстрое достижение полноты разрушения органических веществ.
2. Полнота разрушения объекта обусловливает большую чувствительность методов анализа катионов металлов.
3. Малый объем получаемого минерализата, что также повышает чувствительность методов анализа.
Основным недостатком метода являются большие потери Нg (до 90-98%) за счет её летучести. Поэтому изолирование ртути в виде ионов проводят в отдельной навеске биообъекта частным методом изолирования, который исключает использование высоких температур, процесс ведется в присутствии катализатора (этанола).
Метод минерализации смесью серной, азотной и хлорной кислот (1:1:1)
Кислоту хлорную в качестве окислителя в аналитической химии впервые применил А.Щербак в 1893 году.
В качестве окислительной смеси при изолировании этим методом используют смесь из равных объемов концентрированной H2SO4 и концентрированной HNO3 и 37% или 42% НСlO4. Методика выполнения изолирования аналогична первому методу, однако второй метод имеет ряд несомненных достоинств:
1. Высокая скорость минерализации, сокращение в 2-3 раза затрат времени в сравнении с первым методом.
2. Очень высокая степень окисления органических веществ (до 99 %), что обусловлено способностью хлорной кислоты разрушать вещества стойкие или медленно разлагающиеся другими окислителями.
3. Окисление большинства поливалентных металлов до высших степеней окисления.
4. Небольшой расход окислителей.
5. Малый объем получаемого минерализата, что повышает чувствительность методов анализа.
Основной недостаток тот же, что и у первого метода – практическая полная потеря ртути. Однако есть еще одна опасность при использовании кислоты хлорной в составе окислителей - это взрывоопасность и токсичность хлорной кислоты. Безводная кислота хлорная нестойкая, может взрываться при хранении при повышенной температуре или при соприкосновении с некоторыми органическими соединениями. Это требует соблюдения особых мер предосторожности при работе с кислотой хлорной.
При любом способе минерализации следует соблюдать меры предосторожности, т.к. возможны термические ожоги, выбрасывание горячих кислот из колб и даже взрывы (особенно при использовании в качестве окислителей пергидроля, хлорной кислоты и хлората калия). Поэтому следует пользоваться защитными очками, работать в вытяжных шкафах с хорошей тягой.
Нельзя не остановиться ещё на одном очень важном этапе исследования «металлических ядов» - проверке чистоты реактивов. Недостаточно чистые кислоты - окислители могут загрязнять минерализаты соединениями металлов, при этом количество примесей может оказаться весьма значительным, что послужит основанием для ошибочного заключения о наличии «металлических ядов в биоматериале и причине отравления. Чтобы исключить ошибку, необходимо применять кислоты, свободные от примесей. Если степень их чистоты неизвестна, то проводят «холостой опыт», т.е. берут реактивы в нужных для методики количествах и полностью воспроизводят её. Только при отрицательных эффектах реакций обнаружения металлов, делают вывод о пригодности кислот для использования в процессе минерализации.
Независимо от того, каким методом проводилась минерализация биологического материала, минерализат в большинстве случаев содержит окислители, которые помешают дальнейшему проведению анализа. Это азотная, азотистая кислоты, оксиды азота, нитрозилсерная кислота. Для их удаления используются методы денитрации. Применяемые ранее гидролизный метод, метод денитрации мочевиной, натрия сульфитом практически вытеснены методом денитрации формальдегидом. Метод предложен в 1952 году Т.В.Зайковским. Процесс денитрации заканчивается за 1-2 минуты, избыток непрореагировавшего формальдегида легко удаляется при нагревании в течение 5-10 минут. Для проверки полноты денитрации минерализата проводят реакцию с дифениламином в среде концентрированной кислоты серной.
Полученную после минерализации жидкость, в которой металлы находятся в виде сернокислых солей, разбавляют водой до определенного объема в мерной колбе (200мл) и используют для проведения качественного анализа "дробным" методом и количественного определения.
3.3.2. Методика изолирования металлических ядов из биологического материала общим методом минерализации
100 г биологического объекта в колбе Къельдаля заливают 75 мл окислительной смеси (кислоты серной концентрированной, кислоты азотной концентрированной, воды дистиллированной в соотношении 1:1:1). Колбу закрепляют в штативе вертикально на расстоянии 1-2 см от асбестовой сетки. Над колбой помещают капельную воронку с разбавленной азотной кислотой (1:1). Колбу осторожно взгревают на плитке, добавляя при необходимости (потемнение жидкости) разбавленную азотную кислоту (1:1) по каплям до просветления жидкости. Концом минерализации считается момент, когда в колбе остается 15-20 мл бесцветной или окрашенной жидкости, которая не темнеет в течение 30 минут при постоянном нагревании, без добавления кислоты азотной. Охлажденный минерализат осторожно выливают в химический стакан, содержащий 30 мл дистиллированной воды, колбу Къельдаля ополаскивают два раза дистиллированной водой по 10мл и присоединяют промывные воды к разбавленному минерализату. Разбавление минерализата способствует затем более легкому протеканию процесса денитрации.
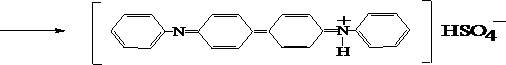
В маленькой фарфоровой чашке в 2-3 каплях концентрированной кислоты серной растворяют 2-3 кристалла дифениламина и к полученному бесцветному раствору прибавляет одну каплю разбавленного минерализата. В случае появления сине-голубого окрашивания проводят денитрацию раствора.
Дифениламин
Стакан с содержимым ставят на плитку, нагревают до кипения и вносят одну каплю формалина; кипятят 10 минут и вновь проделывают реакцию дифениламином.
Химизм денитрации:
4 HNO2 + 2 H2CO ® 2 NO + N2 + 2 CO2 + 4 H2O
4 HNO3 + 3 H2CO ® 4 NO + 3 CO2 + 5 H2O
4 HNO3 + 5 H2CO ® 2 N2 + 5 CO2 + 7 H2O
В случае отсутствия голубого окрашивания в результате реакции с дифениламином жидкость кипятят до исчезновения запаха формалина, охлаждают, количественно переносят в мерную колбу на 200 мл и доводят водой очищенной до метки. Жидкость из мерной колбы переносят в чистую сухую склянку и используют для обнаружения катионов (100 мл) и количественного определения (100 мл). Если при разбавлении минерализата водой выпадает осадок, то независимо от того, проводилась денитрация или нет, жидкость в стакане нагревают до кипения, кипятят 10 минут и оставляют стоять на сутки для получения более плотного осадка. На второй день белый кристаллический осадок отфильтровывают через плотный фильтр
В осадке после проведения минерализации могут находиться нерастворимые в воде сульфаты бария, свинца и кальция. Химико-токсикологический интерес представляют только барий и свинец, которые необходимо до обнаружения разделить.
Для этого осадок отфильтровывают через плотный фильтр, промывают 2 – 3 раза водой очищенной и присоединяют промывные воды к фильтрату, доводя его до метки в мерной колбе.
Осадок на фильтре 2 раза промывают водой, подкисленной 1 % раствором кислоты серной. Промывные воды отбрасывают. Затем осадок на фильтре многократно обрабатывают 5 мл горячего насыщенного раствора аммония ацетата, подкисленного кислотой уксусной (каждый раз нагревая фильтрат).
PbSO4 + 2 CH3COONH4 ® (CH3COO)2Pb + (NH4)2SO4
Этот, второй фильтрат, исследуют на ионы свинца, а осадок на фильтре – на ионы бария.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 418; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.81.172 (0.008 с.) |