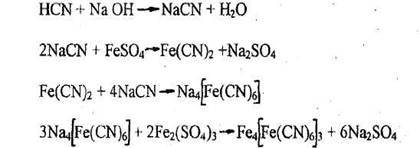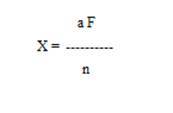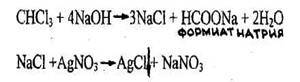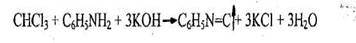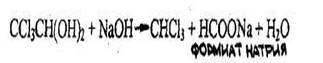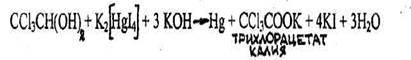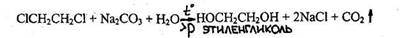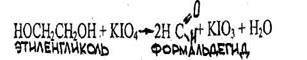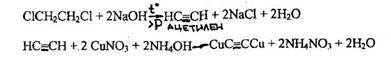Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Группа веществ, изолируемых дистилляцией («летучие яды»)Содержание книги
Поиск на нашем сайте
В данной главе дана общая характеристика группы «летучих ядов»; основы перегонки с водяным паром (для простых и азеотропных смесей). Определены объекты судебно-химического исследования; основы пробоподготовки; необходимая аппаратура и техника перегонки для проведения анализа на группу «летучих ядов». Рассмотрены современные методы изолирования, их характеристика, дана сравнительная оценка методам (рассмотрена дистилляция с водяным паром, микроперегонка и микродиффузия).
Определено токсикологическое значение некоторых летучих ядов. Показано использование химических реакций при обнаружении «летучих ядов».
Отдельно рассмотрено обнаружение цианидов методом микродиффузии. Показано количественное определение цианидов. Рассмотрено обнаружение алкилгалогенидов, альдегидов и кетонов, фенола, уксусной кислоты.
Отдельно рассмотрены спирты, токсикокинетика спиртов, распределение в организме, биотрансформация, экскреция. Определены объекты исследования при проведении анализа на спирты. Рассмотрены правила отбора проб у живых лиц, трупного материала. Показаны химические свойства спиртов, химические реакции для обнаружения спиртов в дистилляте (метанола, этанола, изоамилового спирта, пропилового, бутилового спиртов и этиленгликоля).
Особое внимание уделяется этиловому спирту. Показаны свойства, механизм действия на организм человека; его токсичность. Определены проблемы и распространенность алкоголизма, экспертиза алкогольного опьянения, клиника отравлений этиловым спиртом. Выделены методы анализа, применяемые в определении наркотического опьянения (качественно-количественные). Показаны предварительные качественные пробы на этиловый алкоголь при исследовании выдыхаемого воздуха и биологических жидкостей (проба Рапопорта А.М., индикаторные трубки Мохова – Шинкаренко).
Показана необходимость количественного определения спиртов (химические и современные биохимические методы исследования; газохроматографический метод исследования этилового спирта).
4.1. ОБЩАЯ ХАРАКТЕРИСТИКА ГРУППЫ В химико-токсикологическом анализе деление токсикологически важных веществ на группы основано на способах их изолирования из исследуемого объекта. Таких групп насчитывается шесть, причем три из них подлежат обязательному судебно-химическому исследованию при проведении полного (общего) судебно-химического анализа.
Одной из групп токсикологически важных веществ, подлежащих обязательному исследованию, являются «летучие яды», или вещества, изолируемые дистилляцией. Все они изолируются из биологического объекта одним из наиболее старых и широко используемых методов дистилляцией - перегонкой с водяным паром.
В группу «летучих ядов» входят вещества, различные по своей химической природе:
1. Синильная кислота HCN имеет собственную низкую температуру кипения + 26,5°С и занимает первое место по своей летучести с водяным паром.
2. Алкилгалогениды: СНС13 (хлороформ)
Cl3C-CH(OH)2 (хлоралгидрат)
ССl4 (четыреххлористый углерод)
C2H4CI2 (дихлорэтан)
C2Cl6 (гексахлорэтан)
СН2О (формальдегид)
СНз-СО-СНз (ацетон)
4. Алканолы (спирты):
СНзОН (метанол)
С2Н5ОН (этанол)
С3Н7ОН (пропанол)
С4Н9ОН (бутанол)
С5Н 11ОН (пентанол)
диолы СН2 ОН -СН2 ОН (этиленгликоль)
5. Сложные эфиры алифатического ряда:
CH3COOC2H5 (амилацетат)
6. Карбоновые кислоты алифатического ряда:
CH3COOH (кислота уксусная)
CH3-СНOH-СООН (кислота молочная или альфа-оксипропионовая)
7. Сероуглерод CS2
8. Элементоopгaнические соединения жирного ряда:
(C2H5)4Pb (тетраэтилсвинец)
9. Ароматические углеводороды:
С6Н6 (бензол)
CH3-С6Н5 (толуол)
ксилолы (содержат два радикала -СНз в бензольном кольце в различных положениях)
10. Нитро- и аминопроизводные ароматического ряда:
С6Н5NО2 (нитробензол)
С6Н5NH2 (анилин)
11. Оксипроизводные ароматического ряда:
С6Н5ОН (фенол)
крезолы
кислота салициловая (о-оксибензойная)
12. Фосфор и первые продукты его окисления и восстановления
Н3РО2 (кислота фосфорноватистая)
Н3РО3 (кислота фосфористая)
PH3 (фосфин)
ФОСы (эфиры фосфорных кислот)
13. Жидкие алкалоиды:
кониин
никотин
анабазин
Из перечисленных соединений согласно действующего до настоящего времени приказа Минздрава СССР №1021 от 25.12.73 г., в обязательный круг химико - токсикологического исследования при проведении общего анализа включены:
1. Кислота синильная.
2. Алкилгалогениды: хлороформ, дихлорэтан.
3. Альдегиды: формальдегид.
4. Алканолы: метанол, этанол, пропанол, бутанол, пентанол, изоамиловый спирт.
5. Оксипроизводные ароматического ряда: фенол, крезолы.
По физическим свойствам «летучие» яды, в основном, представляют собой летучие жидкости (за исключением таких твердых веществ, как хлоралгидрат, фенол, салициловая кислота, фосфорорганические соединения).
Способность химических соединений перегоняться с водяным паром зависит от их физических свойств. С водяным паром перегоняются некоторые жидкости, практически не смешивающиеся или ограничено смешивающиеся с водой, азеотропные смеси. Известны также вещества (метанол, ацетон, уксусная кислота, этиленгликоль и др.), которые смешиваются с водой и перегоняются с водяным паром, но не образуют азеотропных смесей.
При перегонке смесей органических веществ большое значение имеет их взаимная растворимость. При этом возможны 3 случая:
1 Жидкости взаимно не растворимы, т.е. образуют двухфазную систему. При перегонке с водяным паром одной из фаз является вода.
2. Жидкости ограниченно растворимы друг в друге, т.е. двухфазная система образуется только при определенных соотношениях компонентов. Такую систему образуют с водой толуол, нитробензол, дихлорэтан, тетраэтилсвинец и др.
3. Компоненты смешиваются в любых соотношениях, т.е. вещества растворимы в воде, образуется однофазная система. С водой такую систему образуют метанол, ацетон, формальдегид, этиленгликоль, уксусная кислота.
В случае образования двухфазной системы (жидкости, не растворимые или ограниченно растворимые в воде) при нагревании смеси давление пара каждой жидкости будет таким же, как и давление ее пара в чистом виде, независимо от наличия другой жидкости. Каждая жидкость в смеси будет вести себя так, как будто отсутствует другая жидкость.
В основе перегонки взаимонерастворимых веществ с водяным паром лежит закон Дальтона.
Согласно этому закону общее давление паров смеси (упругость) равно сумме парциальных давлений (упругостей) ее компонентов при данной температуре.
Р общее = Р воды +Р вещества
При нагревании компоненты смеси увеличивают упругость своих паров независимо друг от друга. Когда общее давление достигнет атмосферного и превысит его на незначительную величину смесь закипает и начинает перегоняться, при этом температура кипения смеси ниже температур кипени каждого из её компонентов в чистом виде за счет сложения их парциальные давлений.
Поскольку одним из компонентов является вода, то вещества буду перегоняться при t°<1000C. Особенно удобна дистилляция с водяным паром в тех случаях, когда изолируемое вещество имеет очень высокую температуру кипения или же разлагается при своей температуре кипения.
Так, для того, чтобы перегонять анилин в чистом виде, требуется нагреть его до температуры кипения, равной 184°С, в смеси же с водой он перегоняется при температуре 75°С.
Такое токсичное вещество, как тетраэтилсвинец, разлагается при своей температуре кипения, равной 200°С.
Кроме того, при проведении судебно-химического исследования сильный нагрев нежелателен, т.к. при высокой температуре может произойти подгорание органических веществ исследуемого объекта и образование следовых количеств синильной кислоты, что приведёт к ложноположительным результатам анализа.
Таким образом, при дистилляции с водяным паром понижается температура кипения перегоняемых соединений и устраняется опасность их термического разложения.
Для многих органических веществ способность перегоняться с водяным может быть объяснена образованием с водой азеотропных (нераздельнокипящих) смесей, состав которых не меняется при перегонке (например, 96% этанола и 4% воды).
Азеотропными называются смеси, у которых пар, находящийся в равновесии с жидкостью, обладает теми же свойствами, что и сама жидкая смесь. Они перегоняются при постоянной температуре и не могут быть разделены простой или фракционной перегонкой.
Из веществ, летучих с водяным паром и представляющих токсикологический интерес азеотропные смеси образуют: алкилгалогениды (хлороформ, ССl4)
§ этиловый и изоамиловый спирты
§ фенол, анилин и др.
В случае образования однофазной системы (жидкости растворимы в воде), если индивидуальная температура кипения вещества низкая (ацетон, метиловый спирт), то оно перегоняется быстро и полностью.
При высокой t°кип обычно полноты отгонки не достигается, при этом приходится использовать селективные переносчики, чтобы образовалась низкокипящая смесь. Так, при перегонке этиленгликоля с водяным паром в качестве селективного переносчика используют бензол, а для уксусной кислоты – гептан. При этом, если температура кипения этиленгликоля составляет 197°С, то смесь этиленгликоль-вода-бензол перегоняется при 118° С. Для уксусной кислоты соответственно 118° С и 80° С.
Оценка метода: очень простой, быстрый, экономичный, не требует специальной аппаратуры. Анализируемые вещества изолируются в чистом виде, только сильно разбавлены водой, поэтому перегонку с водяным паром можно рассматривать не только как метод изолирования, но и как метод очистки.
Объекты судебно-химического исследования. Пробоподготовка
В качестве объектов судебно-химического исследования с целью обнаружения «летучих ядов» на экспертизу обычно направляются внутренние органы трупа, кровь, моча. При подозрении на отравление хлорорганическими веществами дополнительно направляется сальник и 1/3 головного мозга, метанолом - 1/3 головного мозга, этанолом - кровь из крупных вен, моча, мышечная ткань.
Объекты помещают в банки, которые герметично закрывают и опечатывают и немедленно пересылают в лабораторию для исследования. При подозрении на отравление этанолом задержка с транспортировкой материала на 5-10 суток может служить причиной недостоверных результатов его количественного определение.
Методика: Объект в количестве 100 г тщательно измельчают, смешивают с водой до густой кашицы, помещают в круглодонную колбу таким образом, чтобы она заполнилась не более чем на 1/3 её объема, подкисляют кислотой щавелевой или виннокаменной до рН 2-3 и подвергают перегонке.
Подкисление объекта органической кислотой проводят с той целью, чтобы превратить нелетучие соли синильной кислоты (цианиды калия, натрия), в виде которых она находится в биологическом объекте, в свободную HCN, являющуюся легко летучим соединением.
NaCN-------->HCN
В данном случае нельзя воспользоваться сильными минеральными кислотами, т.к. это привело бы:
1) к разрушению молекулы HCN (гидролиз), что приведет к eё потере и недооткрытию.
2) к переоткрытию фенола в результате гидролиза его сернокислых эфиров, (являющихся нормальной частью биологического материала).
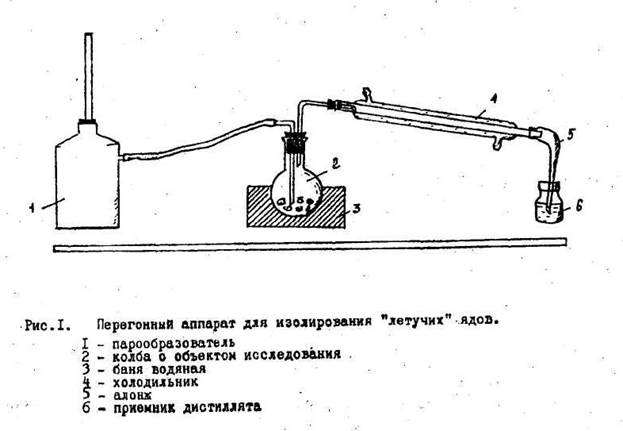
4.2. СОВРЕМЕННЫЕ МЕТОДЫ ИЗОЛИРОВАНИЯ «ЛЕТУЧИХ ЯДОВ» Аппаратура и техника перегонки Дистилляция с водяным паром проводится в специальном приборе, который состоит из трех основных частей: герметично соединенных друг с другом:
1. Парообразователь
2. Колба с исследуемым объектом (помещается на водяную баню)
3. Холодильник с приемником
Сборку установки начинают со стороны приемника, в последнюю очередь к колбе с исследуемым объектом присоединяют заранее нагретый парообразователь (разборка ведется в обратном порядке). Водяную баню, в которой стоит колба с объектом, также нагревают, чтобы избежать конденсации водяного пара.
Дистилляцию проводят медленно, так, чтобы можно было считать капли отгона
Собирают 2-3 дистиллята. Первый в количестве 1-3 мл собирают в приемник с 5% раствором натрия гидроксида для улавливания легколетучей синильной кислоты и превращения ее в нелетучий цианид натрия. При этом алонж холодильника должен быть погружен в раствор NaOH, чтобы избежать потерь летучей HCN. Весь первый дистиллят используют для обнаружения синильной кислоты.
Второй (и третий) дистиллят собирают в пустой, чистый приемник в количестве 20-30 мл и используют для обнаружения всех остальных веществ из группы «летучих ядов». Двух-трех отгонов обычно бывает достаточно для качественного исследования.
При проведении исследования на группу «летучих» ядов, необходимо
обращать внимание на следующее:
1. Запах объекта (иногда это может дать какие-либо дополнительные ориентирующие данные). Правда, запах биологического объекта, как правило, маскирует запах летучего ядовитого вещества, но в некоторых случаях все же возможно определение запаха искомого соединения. Например, изоамиловый спирт придает объекту запах сивушных масел, нитробензол и синильная кислота запах горького миндаля.
2. Запах и внешний вид дистиллята. Перед выполнением химического исследования обязательно проводят наружный осмотр дистиллята, обращая внимание на его прозрачность или мутность, наличие капель на дне склянки или маслянистой пленки на поверхности жидкости, наличие характерного запаха.
Так изоамиловый спирт легче воды и плохо смешивается с ней, поэтому при содержании значительных количеств изоамилового спирта дистиллят обладает характерным раздражающим запахом сивушных масел и иногда содержит на поверхности маслянистые капли или даже два слоя этого вещества.
Присутствие в отгоне фенола можно обнаружить по характерному запаху карболовой кислоты и молочновидному помутнению, поскольку фенол плохо растворим в воде. При больших количествах фенола на дне приемника могут присутствовать бесцветные или розоватые капли (продукты окисления фенола).
Хлороформ и четыреххлористый углерод тяжелее воды и не смешиваются с ней, поэтому на дне приемника можно наблюдать бесцветные капли или слой этих веществ.
Исследование дистиллятов с целью идентификации веществ из группы «летучих ядов» традиционно строится на использовании микрохимических реакций. Так, реакция образования берлинской лазури, которая является высокочувствительной и специфичной для доказательства синильной кислоты имеет положительное судебно-химическое значение (т.е. на основании одной этой реакции можно дать положительное заключение о наличии в исследуемом объекте HCN). Она является особенно ценной еще и потому, что образующийся характерный осадок может быть представлен в качестве вещественного доказательства судебно-следственным органам.
Известно, что общей реакцией на алкилгалогениды является реакция отщепления органически связанного хлора. Реакция достаточно чувствительна, но не специфична. О таких реакциях принято говорить, что они имеют отрицательное судебно-химическое значение.
Заключение о присутствии того или иного из «летучих ядов» делается на основании комплекса реакций.
Кроме перегонки с водяным паром в токсикологической химии применять еще два метода дистилляции:
1. Микроперегонка
2. Микродиффузия
Микроперегонка. В последние годы исследование токсикологически важных «летучих» веществ все шире проводится методом газожидкостной хроматографии. Для изолирования в этом случае используется микроперегонка, поскольку количество объекта составляет 1-5 г.
Метод основан на ускоренной диффузии «летучих» веществ биологической пробы при повышенной температуре в присутствии сильных электролитов и проводится в герметически закрытом флаконе. Парогазовая фаза отбирается микрошприцем и используется для анализа.
Микродиффузия. Не потерял своего значения и метод микродиффузии, позволяющий обнаружить малые количества в объекте. Прибор для микродиффузии представляет собой небольшой круглый толстостенный сосуд из стекла, внутри которого расположен второй сосуд меньшего диаметра. Таким образом, имеется внутренняя круговая стенка и наружная кольцевая камеры. К верхнему краю герметично пришлифовывается крышка.
Исследуемый объект вносится в наружную камеру, а поглощающая жидкость - во внутреннюю. К объекту в наружную камеру на расстоянии 2-3 см от него помещают раствор вещества-электролита, который способствует переходу летучего соединения в пространство прибора. Прибор закрывают крышкой, слегка наклоняют для смешивания объекта и электролита, после чего оставляют на время, необходимое для диффузии. При этом летучие вещества из объекта сначала переходят в пространство прибора, а затем в растворитель во внутренней камере (или в раствор реактивов, реагирующих с этими веществами). В этой жидкости их и определяют.
На скорость перехода летучих веществ в пространство прибора влияют некоторые электролиты. Так, прибавление раствора калия карбоната к крови или тканям, содержащим этанол, ускоряет его диффузию.
4.3. ТОКСИКОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ НЕКОТОРЫХ ЛЕТУЧИХ ЯДОВ
4.3.1.СИНИЛЬНАЯ КИСЛОТА (цианистый водород, нитрил муравьиной кислоты) Синильная кислота HCN представляет собой бесцветную, подвижную жидкость с запахом горького миндаля. Т. кип. 25,65 °С. Смешивается с водой и многими органическими растворителями (спирты, эфиры, ароматические углеводороды, четыреххлористый углерод и др.). Синильная кислота - слабая кислота, образует с металлами соли - цианиды.
В свободном и связанном виде синильная кислота встречается в растениях, чаще всего в виде гликозида амигдалина, содержится в коксовом газе, табачном дыме, образуется при термическом разложении найлона, полиуретанов и др.
Синильную кислоту применяют в производстве цианидов, хлорциана,
акрилонитрила, акрилатов, аминокислот, гидроксинитрилов, как фумигант.
Сильно токсична, задерживает окислительные и ферментативные процессы,
связывает гемоглобин в циангемоглобин, парализует дыхательный центр и вызывает удушье; проникает через неповрежденную кожу.
Цианиды калия и натрия - реагенты для извлечения серебра и золота из руд, реактивы в комплексонометрическом анализе для определения серебра, никеля и ртути, компоненты электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Высокотоксичны, вызывают удушье вследствие паралича тканевого дыхания. Порошки и растворы KCN раздражают кожу.
Качественное обнаружение синильной кислоты
1. Реакция образования берлинской лазури
Появление синего осадка или синей окраски указывают на наличие синильной кислоты. При малых количествах синильной кислоты в растворах окраска появляется только через 24-48 час.
При изучении данной реакции следует проделать ее несколько раз со все уменьшающейся концентрацией исследуемого вещества в растворе.
Чувствительность реакции - 20 мкг синильной кислоты в 1 мл раствора. Реакция специфична и имеет положительное судебно-химическое значение.
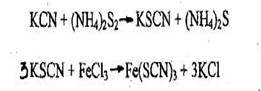
2. Реакция образования роданида железа
Появление кроваво-красной окраски указывает на наличие цианидов в растворе. При взбалтывании окрашенного раствора с диэтиловым эфиром окраска переходит в эфирный слой.
Чувствительность реакции - 10 мкг синильной кислоты в 1 мл. Обнаружение цианидов методом микродиффузии Метод микродиффузии обнаружения синильной кислоты и её солей основан на реакции с пиридином и барбитуровой кислотой. Суть реакции заключается в расщеплении пиридинового цикла при действии хлорамина Т в щелочной среде - с образованием производного глутаконового альдегида. Производное глутаконового альдегида малоустойчивое соединение, существующий в двух таутомерных формах, который далее конденсируется с барбитуровой кислотой с образованием окрашенного соединения.
В наружную камеру прибора для микродиффузии вносят 2-4 мл крови
или мочи (или 1 г гомогената ткани), прибавляют 3-4 капли 10 % раствора
кислоты серной. Во внутреннюю камеру прибора наливают 3,3 мл 0,1 моль/л
раствора натрия гидроксида. Прибор плотно закрывают крышкой и оставляют на 3-4 ч при комнатной температуре. Затем из внутренней камеры берут 1 мл жидкости, прибавляют 1 мл 0,1 моль/л раствора натрия гидроксида, 2 мл 1 моль/л раствора натрия гидрофосфата и 1 мл 0,25 моль/л раствора хлорамина Т. Жидкость взбалтывают и через 2-3 мин прибавляют 3 мл реактива, содержащего барбитуровую кислоту и пиридин. Смесь взбалтывают и оставляют на 10 мин. Появление красной окраски указывает на присутствие цианидов в исследуемой жидкости.
Количественное определение
Для количественного определения изолирование синильной кислоты
проводят из отдельной навески биологического материала. Перегонку ведут до тех пор, пока последняя порция дистиллята не перестанет давать реакции образования берлинской лазури. При исследовании свежего биологического материала можно использовать титриметрический метод анализа. Весовой метод применяют к свежему и загнившему биологическому материалу.
1. Титриметрический метод. Метод основан на взаимодействии синильной кислоты с 0,1 моль/л (или 0,01 моль/л при малых количествах синильной кислоты) раствором серебра нитрата. Непрореагировавший серебра нитрат оттитровывают 0,1 моль/л (или 0,01 моль/л) раствором аммония или калия тиоцианата, индикатор - железо-аммониевые квасцы.
2. Весовой метод. Дистиллят собирают в 2-3 приёмника, соединенных между собой и содержащих 0,2 % раствор серебра нитрата. По окончании отгонки содержимое приёмников обмывают водой очищенной и промывные воды присоединяют к основной жидкости. Раствор подкисляют кислотой азотной до кислой реакции по лакмусу и осадок количественно переносят на фильтр. Полученный осадок промывают раствором аммиака для растворения серебра цианида от нерастворимого в нём серебра сульфида. Фильтрат подкисляют кислотой азотной разбавленной до резко кислой реакции (рН1-2) на лакмус, выделившийся осадок серебра цианида отфильтровывают, промывают водой очищенной и высушивают вместе с фильтром. Затем фильтр сжигают и осадок прокаливают во взвешенном фарфоровом тигле до постоянного веса.
Осадок металлического серебра взвешивают и пересчитывают на кислоту синильную по формуле:
где X - количество исследуемого вещества в мг;
а - вес весовой формы в мг;
F - коэффициент пересчёта, равный для синильной кислоты (по серебру);
n - навеска исследуемого вещества в г.
4.3.2. АЛКИЛГАЛОГЕНИДЫ Алкилгалогениды находят широкое применение в лакокрасочной, кожевенной, электротехнической, фармацевтической промышленности; при приготовлении полимерных материалов как пластификаторы, мономеры и сополимеры. Используются в качестве растворителей, в том числе для обезжиривания и экстрагирования жиров и эфирных масел, хладагентов, пестицидов, в органическом синтезе, при производстве каучука, резинотехнических изделий.
Почти все хлорпроизводные алканов опасные яды. Максимальная смертность отмечается при отравлениях хлороформом, четырёххлористым углеродом, 1,2-дихлорэтаном. В картине отравления помимо фазы наркоза, которая проявляется преимущественно при ингаляционных отравлениях, выделяют и токсическую. Токсическая фаза, протекающая с поражением печени, почек и ЦНС, наиболее выражена при приёме хлорпроизводных алканов внутрь, но отмечается и при других путях поступления. Токсичность хлорпроизводных алканов усиливается при одновременном или предварительном действии этанола, как при ингаляции, так и при внутрижелудочном введении. Потенцирующее действие отмечается при комбинации хлорпроизводных алканов и с другими алифатическими спиртами.
Усиление загрязнения окружающей среды хлорпроизводными углеводородов - вероятная причина роста раковых заболеваний.
Поступают в организм при ингаляции, перорально, через кожные покровы.
Определение летучих хлорпроизводных алканов в выдыхаемом воздухе основано на последовательном применении ГХ и масс-спектрометрии. Используют также ГЖХ и хромато-масс-спектрометрический метод. В воде -ГХ и спектрофотометрические. В биологическом материале определяют ГХ и масс-спектрометрическими методами. Применяют также хроматографию в тонком слое. Сохраняют значение методы, основанные на реакции Фудживара - окрашивание раствора пиридина при взаимодействии с хропроизводными углеводородов в щелочной среде.
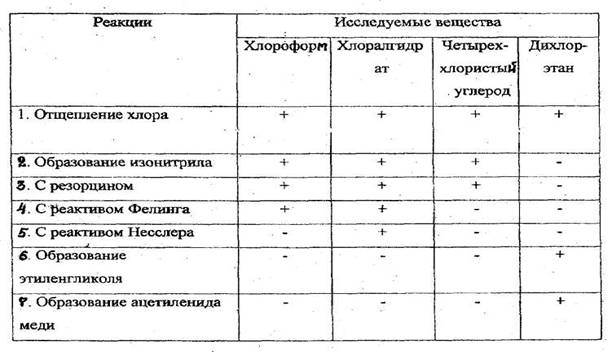
4.3.2.1.ХЛОРОФОРМ(трихлорметан) СНСl3 Хлороформ представляет собой бесцветную прозрачную жидкость с резким характерным запахом, сладковатым, жгучим вкусом; т. кип. 61,1°С; образует азеотропную смесь с водой (т. кип. 56,2 °С, 97,4 % хлороформа). Используют хлороформ главным образом для производства хладона 22, как растворитель, хладагент, в синтезе лекарственных препаратов. Ранее применялся в медицине как средство для наркоза. Хлороформ - негорюч, на свету разлагается, особенно при контакте с открытым пламенем, образуя фосген. Вызывает наркоз. Обладает гепатотропным, нефротоксическим и кардиотоксическим действием; вызывает канцерогенный и мутагенный эффекты; раздражает слизистые оболочки.
Качественное обнаружение
Появляется белый осадок, растворимый в растворе аммиака. Параллельно проводят пробу в тех же условиях с 1 мл исследуемого раствора и натрия гидроксидом, но без нагревания (для исключения ионов хлора в исследуемом растворе).
Реакция не специфична, является общей для всех хлорпроизводных. Чувствительность реакции 0,2 мг.
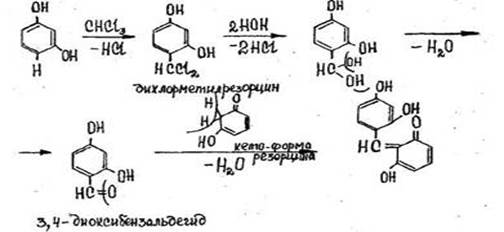
После нагревания пробирки на кипящей водяной бане в течение 5-10 мин. появляется розовая или малиновая окраска. Параллельно выполняется контрольный опыт («слепой» опыт), цель которого - исключить ошибки за счет продуктов окисления резорцина, окрашенных в зеленый цвет и маскирующих розовое окрашивание.
Реакция не специфична, ее дают все хлорпроизводные, кроме дихлорэтана, а также формальдегид.
Появляется резкий раздражающий запах изонитрила. Реакция не специфична, ее дают все хлорпроизводные, за исключением дихлорэтана.
Чувствительность реакции 0,01 мг.
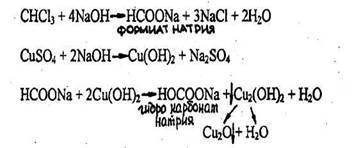
Выпадает желтый осадок гидрооксида меди (Cu(OH)2), переходящий в красный осадок закиси меди (Cu2O).
Реакция не специфична, ее дает хлороформ, хлоралгидрат и формальдегид. Не дают четыреххлористый углерод и дихлорэтан. Чувствительность реакции 3 мг.
4.3.2.2. ХЛОРАЛГИДРАТ (2,2,2-трихлорэтандиол-1,1) СС13СН(ОН)2 Бесцветные, прозрачные кристаллы или мелкокристаллический порошок с характерным острым запахом, слегка горьковатого вкуса. Т.пл. 51,4 °С, т. кип. 97,5 °С. Растворим в этаноле, диэтиловом эфире, слабо растворим в бензоле, сероуглероде.
Применяют как успокаивающее внутрь и ректально, как снотворное и противосудорожное средство.
Признаки острого отравления при передозировке: глубокий сон, затем наркотическое состояние, ослабление дыхания и падение сердечной деятельности.
Качественное обнаружение
Хлоралгидрат дает все реакции, которые используют для обнаружения хлороформа (см. реакции 1-4), т.к. они проводятся в присутствии щелочи, под влиянием которой хлоралгидрат разлагается с выделением хлороформа:
Для отличия хлоралгидрата от хлороформа используются следующие пробы:
Образуется кирпично-красный осадок, который затем становится грязно-зеленым. Другие хлорпроизводные этой реакции не дают.
Реакция не специфична, ее дают альдегиды и другие восстановители.
2. Экстракция из дистиллята (при положительном результате проведённых реакций 1-4).
Часть дистиллята 2-3 раза встряхивают в делительной воронке с порциями эфира по 5 мл, эфирные вытяжки соединяют и фильтруют через сухой фильтр в фарфоровую чашку. Фильтрат выпаривают досуха при комнатной температуре под тягой. Если в дистилляте был хлороформ, то он улетучивается вместе с эфиром. При наличии хлоралгидрата в чашке остается остаток кристаллического вещества. Для подтверждения хлоралгидрата в остатке к нему прибавляют 2-Змл воды и полученный раствор подвергают исследованию при помощи вышеуказанных реакций.
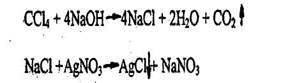
4.3.2.3. ЧЕТЫРЕХХЛОРИСТЫЙ УГЛЕРОД (тетрахлорметан) ССl4 Бесцветная жидкость с резким сладковатым запахом, т. кип. 76,7 °С, образует азеотропную смесь с водой (т. кип. 66 °С, 95,9 % четыреххлористого углерода). Четыреххлористый углерод - сырье для производства хладонов, растворитель, огнетушащее средство. Четыреххлористый углерод - негорюч, взрыво- и пожароопасен. Ядовит при вдыхании, попадании внутрь через желудочно-кишечный тракт или всасывании через кожные покровы и слизистые оболочки; обладает канцерогенным, мутагенным, тератогенным, эмбриотропным действием.
Качественное обнаружение
1. Реакция отщепления хлора (методика описана выше).
2. Реакция с резорцином в щелочной среде (методика описана выше - см. 4.3.2.1)
3. Реакция образования изонитрила (методика описана выше - см. 4.3.2.2)
В отличие от хлороформа и хлоралгидрата четыреххлористый углерод не дает реакции с реактивом Фелинга, т.к. в процессе нагревания с раствором щелочи не образуется веществ, обладающих восстановительными свойствами.
Заключение о наличии четыреххлористого углерода в дистилляте делают при положительном результате реакций 1-3 и отсутствии результата реакции с реактивом Фелинга.
4.3.2.4. 1.2 -ДИХЛОРЭТАН (хлористый этилен) CICH2CH2CI
Бесцветная жидкость со сладковатым запахом; т. кип. 83,47 °С, образует азеотропную смесь с водой (т. кип. 71,6 °С, 91,8 % дихлорэтана). Используют дихлорэтан главным образом для производства винилхлорида, а также этилендиамина, этиленгликоля, полисульфидных каучуков; как растворитель, фумигант. Дихлорэтан может вызывать психические расстройства, поражения печени и почек, головокружение и рвоту при попадании внутрь или при воздействии паров в концентрациях, превышающих ПДК, равную 10 мг/м3.
Качественное обнаружение
Хлорид-ион доказывают реакцией с нитратом серебра.
Наличие образовавшегося в процессе реакции формальдегида определяют при помощи реакции с хромотроповой или фуксинсернистой кислотами.
Чувствительность реакции 0,4 мг.
При нагревании 1,2-дихлорэтана в запаянной ампуле с раствором натрия гидроксида образуется ацетилен, который при взаимодействии с солями меди дает ацетиленид меди, имеющий розовую или вишнево-красную окраску.
Реакция специфична: другие галогенпроизводные ее не дают. Чувствительность реакции 0,25 мг.
Для отличия 1,2-дихлорэтана от хлороформа, хлоралгидрата и четыреххлористого углерода могут быть использованы изонитрильная реакция, реакция с резорцином и реактивом Фелинга, которых дихлорэтан не дает.
Реакции обнаружения хлорпроизводных, имеющих токсикологическое значение
4.3.3. АЛЬДЕГИДЫ И КЕТОНЫ 4.3.3.1. ФОРМАЛЬДЕГИД (муравьиный альдегид, метаналь) НСНО
Формальдегид представляет собой бесцветный газ с резким раздражающим запахом. Хорошо растворим в воде, спиртах и других полярных растворителях. Чистый газообразный формальдегид относительно стабилен при 80-100 °С, при температурах ниже 80 °С полимеризуется; процесс ускоряется в присутствии полярных растворителей, в том числе воды.
Формалин - водный раствор формальдегида (обычно 37 - 40 %), содержащий 6-15 % метанола (ингибитор полимеризации формальдегида). Представляет собой бесцветную жидкость с характерным острым запахом.
Формальдегид используют в органическом синтезе, в производстве синтетических смол и пластмасс, для синтеза многих лекарственных средств и красителей, для дубления кож, как дезинфицирующее, антисептическое и дезодорирующее средство.
При вдыхании воздуха, содержащего большое количество формальдегида, развиваются явления острого отравления со слезотечением, резким кашлем, чувством стеснения в груди. При приёме внутрь (в большинстве случаев ошибочном) в результате всасывания формальдегида наблюдается потеря сознания, судороги, угнетение нервных центров, раздражение почек.
Качественное обнаружение
1. Реакция с резорцином в щелочной среде
Появляется розовая или малиновая окраска.
Реакция не специфична (дают алкилгалогениды и др.).
Чувствительность 0,03 мкг.
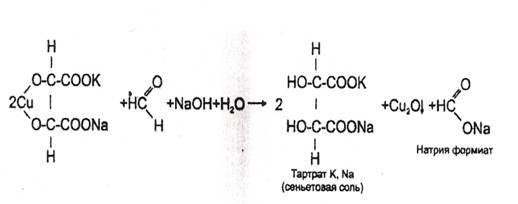
2. Реакция с реактивом Фелинга
В пробирку вносят 1 мл исследуемого раствора, прибавляют 1--2 кап. 10% раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем добавляют 2-3 кап. реактива Фелинга (готовится перед употреблением путем смешивания равных количеств растворов Фелинга №1 и №2). Жидкость сильно взбалтывают и нагревают. При охлаждении на дне пробирки виден желтый или красный осадок оксида меди (I).
Реакция не специфична (дают алкилгалогениды и другие). Имеет отрицательное судебно-химическое значение.
3. Реакция с фуксинсернистой кислотой (реактив Шиффа)
П
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 3723; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.223.191 (0.017 с.) |