Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение диэтилдитиокарбаминовой кислоты и её солейСодержание книги
Поиск на нашем сайте
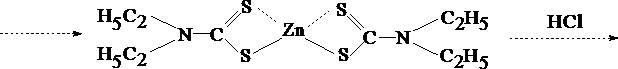
Диэтилдитиокарбаминовая кислота - соединение, неустойчивое в водных растворах, поэтому в аналитической практике используют её натриевую, аммониевую, свинцовую соли. Эти реагенты образуют более чем с 20 металлами внутрикомплексные соединения – диэтилдитиокарбаминаты (ДДТК металлов). В большинстве случаев они используются для целей селективной экстракции катионов из минерализата.
Свойства ДДТК металлов
ДДТК металлов, за исключением ДДТК натрия, нерастворимы в воде, но хорошо растворяются в органических растворителях (хлороформ). Большинство ДДТК металлов - бесцветные соединения. Окраску имеют некоторые растворы комплексных соединений в хлороформе: ДДТК меди имеют яркое желто-коричневое окрашивание, ДДТК висмута, кадмия, сурьмы – бледно - желтое, хрома - бледно-зеленое.
ДДТК металлов образуются при строго определенных значениях pH среды. В щелочной среде образуются комплексы цинка (рН 8,5), кадмия (рН 12,5), висмута (рН 14). Оптимальным значением рН для образования ДДТК меди является рН 3, однако этот комплекс устойчив и в интервале рН от 4 до 11. Таким образом, регулируя рН раствора, можно избирательно изолировать из минерализата тот или иной катион.
Устойчивость ДДТК металлов также связана с рН среды; те комплексы, которые образуются в щелочной среде - неустойчивы в кислой и разрушаются под действием кислот. Это свойство используется для реэкстрации металлов из их комплексов и переведения в водную фазу с целью проведения подтверждающих реакций. Например, ДДТК цинка и кадмия можно разрушить действием кислоты хлористоводородной, а ДДТК висмута - азотной.
Для тех ДДТК металлов, которые устойчивы в широком интервале рН (медь), выделение катиона в водную фазу основано на использовании правила рядов среди диэтилдитиокарбаминатов. Согласно этому правилу каждый предшествующий катион, находящийся в водной фаз, вытесняет последующие катионы из их комплексов, растворенных в хлороформе.
Ряд ДДТК токсикологически важных катионов можно представить следующим образом:
Нg > Аg > Си > Ni > Со > Pb > Bi > Cd > Tl > Sb > Zn > Mn > Fe
Например, Нg 2+ способна вытеснять Си из (ДДТК)2Си, в свою очередь Си 2+
вытесняет Pb из (ДДТК)2 Pb.
Катионы цинка, кадмия, висмута и меди называют экстракционными катионами и их анализ проводят по следующей схеме:
1. Выделение из минерализата в виде комплекса с ДДТКК при определенном рН раствора и экстракция в органическую фазу.
2. Разрушение комплексов кислотами или по правилу рядов – реэкстракция - переведение катионов в водную фазу.
3. Обнаружение и количественное определение.
Применение дитизона Дитизон (дифенилтиокарбазон), введен в аналитическую практику в 1957 году Фишером, который предписывает следующую структуру органического реагента. В зависимости от рН среды, дитизон может существовать в двух таутомерных формах: в кислой среде - в кетоформе, в щелочной среде - в енольной формe.
Кетонная форма Енольная форма
(в кислой и нейтральной среде) (в щелочной среде)
Свойства дитизонатов
1. Дитизон в кетоформе хорошо растворим в органических растворителях и не растворим в воде. В хлороформе образует окрашенные в интенсивно зеленый цвет растворы. В енольной форме дитизон хорошо растворим в воде, но нерастворим в органических растворителях. На этом свойстве основано удаление избытка дитизона из дитизонатов металлов: полученный дитизонат промывают водным раствором аммиака - дитизонат в енольной форме переходит в водную фазу.
2. Большинство дитизонатов металлов - ярко окрашенные соединения растворимые в органических растворителях и нерастворимые в воде Дитизонаты серебра и ртути имеют золотисто-желтый цвет, цинка - пурпурно-красный, свинца - карминно-красный, таллия - красно-фиолетовый.
3. Образование дитизонатов металлов идет при строго определенном значении рН среды. Дитизонаты серебра и ртути образуются при рН 1, цинка рН 4-4,5 (химизм реакции идет по кетоформе дитизона). Для отличия дитизона серебра и ртути полученный комплекс встряхивают с раствором хлористоводородной кислоты, дитизонат серебра разлагается, хлороформный слой окрашивается в зеленый цвет. Дитизонат ртути в этих условиях устойчив. Дитизонат свинца образуется при рН 7-10, таллия - при рН 11-12 (химизм реакции идет по енольной форме дитизона).
МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ При отравлении «металлическими ядами» содержание их в различных органах будет колебаться в зависимости от принятого количества, времени, наступления смерти и оказания помощи. Поэтому для каждого элемента рекомендованы два метода количественного анализа (фотоэлектроколориметрическим и объемный) или один метод определения в широком интервале концентраций.
Классификация и характеристика методов количественного определения
1. Весовой метод (применяется при анализе на барий) обладает самой низкой чувствительностью, границы определения Ва в виде BaSО4 составляет 5 мг.
2. Объемные (титриметрические) методы. Из объемных методов чаще всего применяется комплексонометрия: прямое титрование после экстракции с последующей реэкстракцией при анализе экстракционных катионов (медь, висмут, кадмий, цинк), обратное титрование - для осадочных катионов (барий, свинец). Граница определения - 0,5-1,0 мг. При анализе на катион серебра применяют роданометрический метод, на катион свинца - хромато-иодометрический метод, граница определения этих методов составляет 2,0 мг. Окислительно-восстановительная реакция с получением окрашенных растворов при изменении степени окисления марганца от 2 до 7 лежит в основе колориметрического титрования, границы определения 0,02 мг.
3. Фотометрические методы основаны на измерении оптической плотности окрашенных комплексов металлов с органическими реагентами, граница определения металлов в виде дитизонатов составляет 0,02 мг, в виде ДДТК - 0,1 мг.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 516; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.7.212 (0.01 с.) |