
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование минерализата после отделения осадкаСодержание книги
Поиск на нашем сайте (BaSО4 и PbSО4) Исследование обычно начинают с Mn2+ и Cr 3+, так как определенное мешающее влияние оказывают Cl-. В основу обнаружения и определения этих катионов положены реакции окисления – восстановления.
МАРГАНЕЦ Токсикологическое значение марганца. В последние годы соединения марганца приобретают все большее значение в различных областях промышленности: металлургической, стекольной при изготовлении глазури и эмали, химической, ситцепечатании и др. Применяют также некоторые соединения марганца (КМnО4) в медицине и в санитарии.
Соединения марганца являются сильными протоплазматическими ядами, особенно действуют на центральную нервную систему, вызывая в ней тяжелые органические изменения, поражает также почки, органы кровообращения, легкие.
Марганец получил известность главным образом как профессиональный яд. При действии на организм через органы дыхания соединения марганца приводят к тяжелым поражениям центральной нервной системы, а также действуют на почки, органы кровообращения и легкие. Предельно допустимой концентрацией марганца и его соединений в воздухе является 0,0003 мг/л в пересчете на марганец (Н. В. Лазарев).
Острые отравления соединениями марганца нередко приводят к смерти. Причиной смерти были отравления и калия перманганатом, примененным при криминальном аборте.
Смертельная доза калия перманганата для человека точно неустановленна.
По данным А. О. Войнара, при приеме внутрь она составляет 15—20 г.
При вскрытии трупов лиц, погибших в результате отравления калия перманганатом, характерными считаются ожог слизистой оболочки, напоминающий отравление едкими веществами, дегенеративные изменения паренхиматозных органов, главным образом сердца, печени, почек (О. И. Глазова).
При полосканиях, спринцеваниях концентрированными растворами калия перманганата наблюдается отек слизистых оболочек с последующими воспалительными явлениями, приводящими иногда к общему отравлению организма. Независимо oт способа введения марганец выводится из организма через желудочно-кишечный тракт и с мочой. Основным органом, задерживающим марганец, является печень.
Марганец относится к числу широко распространенных элементов, играющих в организме животных определенную биологическую роль. Этим обстоятельством объясняется обязательное обнаружение марганца при судебно-химическом анализе внутренних органов трупа человека. Этим же диктуется необходимость количественного определения при положительных результатах качественного обнаружения его в биологическом материале.
Общее содержание Mn+2 в организме человека доходит до 0,05%; и в экскриментах его содержится 1,8 мг и в печени 0,17- 0,2 мг на 100 г свежего материала.
А.Н. Крылова дробным методом определяла в 100 г печени 0,13 – 0,40 мг естественно содержащегося Mn2+, в почке и матке 0,06 – 0,28 и 0,04 - 0,16мг.
Обнаружение марганца
Обнаружение марганца основано на реакциях окисления Mn2+ до Mn7+ (перманганат–иона), который окрашивает реакционный раствор в цвета от розового до красно–фиолетового в зависимости от концентрации в минерали-зате.
1. Окисление калия перйоодатом
2 MnSO4 + 5 KIO4 + 3 H2O ® 2 HMnO4 + 5 KIO3 + 2 H2SO4
В присутствии марганца появляется окраска от розового до красно -фиолетового цвета.
2. Окислениеи натрия висмутатом
2 Mn(NO3)2 + 5 NaBiO3 + 16 HNO3 ®
® 2 HMnO4 + 5 Bi(NO3)3 + 5 NaNO3 + 7 H2O
В присутствии марганца появляется розовое окрашивание.
3. Окисление аммония персульфатом
2 MnSO4 + 5 (NH4)S2O8 + 8 H2O ® 2 HMnO4 + 5 (NH4)2SO4 + 7 H2SO4
В присутствии марганца появляется розовое окрашивание.
ХРОМ Токсикологическое значение хрома. Соли хрома широко применяются в различных областях народного хозяйства. Некоторые соединения хрома используются в сельском хозяйстве. В медицине соединения хрома из-за их высокой токсичности в настоящее время не используются.
Наиболее ядовиты хроматы и бихроматы, последние токсичнее хроматов. Соли шестивалентного хрома обладают способностью, действовать раздражающе и прижигающе на кожу и слизистые оболочки, вызывая изъязвления. Типичным признаком является прободение хрящевой части носовой перегородки. В последнее время установлено, что хром обладает канцерогенным действием.
При приемах внутрь наблюдаются ожоги слизистой оболочки рта, пищевода, желудка, припухание, отечность, окрашивание в желтый цвет слизистой полости рта, рвота, иногда кровавая, желтыми или зелеными массами. В литературе имеются разноречивые данные о смертельной дозе солей кислоты хромовой: 0,2 - 0,5 -1 г и даже 8 г (Гадамер). При вскрытии трупов отмечаются явления отравления едкими веществами и желтое окрашивание слизистых оболочек. При острых отравлениях хром накапливается в печени, почках, эндокринных железах.
Хром относится к числу элементов, постоянно обнаруживаемых в организме животных и человека. Описанной выше методикой хром, естественно содержащийся в органах трупа человека, при химико-токсикологическом анализе не обнаруживается.
Обнаружение хрома
При обнаружении хрома, который при минерализации объекта смесью серной и азотной кислот находится в минерализате в основном в степени окисления 3+, его окисляют аммония персульфатом до степени окисления 6+.
В качестве основной реакции используется реакция взаимодействия Cr6+ с дифенилкарбазидом.
1. Реакция с дифенилкарбазидом
Cr2(SO4)3 + 3 (NH4)2S2O8 + 7 H2O
При наличии хрома жидкость в пробирке приобретает красно–фиолетовое окрашивание.
2. Реакция образования надхромовых кислот
В присутствии хрома растворитель окрашивается в сине–голубой цвет.
СЕРЕБРО Токсикологическое значение имеет лишь серебра нитрат. Он оказывает прижигающее и вяжущее действие на кожу и слизистые оболочки. При длительной работе, как с металлическим серебром, так и с его солями может возникать аргирия (отложение металлического серебра в тканях), проявляющаяся в серо-зеленой до аспидно-серой окраске кожи и слизистых оболочек.
Отравления соединениями серебра большей частью являются случайными, но известны также случаи покушения на самоубийство с помощью серебра нитрата. Проф. А. В. Степанов в руководстве по судебной химии указывает, что предметом судебно-химического исследования неоднократно являлись краски для волос, содержавшие серебро. Соединения серебра при этом способны отчасти восстанавливаться в металлическое серебро, а также, частично разлагая содержащие серу вещества волос, переходить в черный серебра сульфид и обусловливать окраску волос. В качестве окрашивающих растворов применялись раствор серебра нитрата или аммиачный раствор серебра хлорида. Второй жидкостью, ускоряющей окраску, обычно являлся раствор натрия сульфида или аммония.
Серебро довольно широко распространено как в низших, так и в высших животных организмах. По А. О. Войнару, в органах человека обнаруживают в пересчете на 100 г свежих тканей в крови - следы, в мозгу - 0,03 мг, в печени - 0,005 мг, в легких - 0,004 мг, в костях - 0,01 мг серебра.
Естественно содержащееся в органах человека серебро не обнаруживается дробным методом анализа.
Обнаружение серебра
1. Основной реакцией при обнаружении серебра является реакция образования серебра дитизоната.
Для отличия серебра дитизоната от ртути дитизоната окрашенный хлороформный слой обрабатывают при энергичном встряхивании 1 мл 0,5моль/л раствором кислоты хлороводородной. Серебра дитизонат в этих условиях разрушается и золотисто - жёлтая окраска хлороформного слоя переходит в зелёную.
При положительном результате реакции с дитизоном серебро из минерализата выделяют в виде серебра хлорида.
2. Рекция образования серебра хлорида
Ag2SO4 + 2 NaCl ® 2 AgCl ¯ + Na2SO4
При наличии иона сереба образуется белый осадок или муть. Жидкость нагревают до кипения и осадок отделяют фильтрованием после охлаждения,
промывают его один раз водой очищенной и растворяют в 0,5 – 2,5 мл 25 % раствора аммиака.
AgCl + 2 (NH4)OH ® [Ag(NH3)2]Cl + 2 H2O
Аммиачный раствор исследуют следующим образом:
а) Каплю раствора помещают на предметное стекло, дают капле медленно (без нагревания) испариться. При наличии серебра выделяются мелкие прозрачные кристаллы в виде кубов, октаэдров, четырёхугольников. (Смотреть под микроскопом при большом увеличении).
б) К капле исследуемого раствора на предметном стекле прибавляют каплю кислоты азотной разведённой – выпадает белый творожистый осадок серебра хлорида.
[Ag(NH3)2]Cl + 2 HNO3 ® AgCl ¯ + 2 NH4NO3
в) 1 – 2 капли исследуемого раствора упаривают на предмет-ном стекле. На остаток наносят по 1 капле насыщенных растворов тиомочевины и калия пикрата. Образуются жёлтые призматические кристаллы в виде розеток пикрата тиомочевинного комплекса серебра: [AgSC(NH2)2] [C6H2(NO2)3OH].
г) 1 – 2 капли исследуемого раствора помещают на фильтровальную бумагу, на которую ранее была нанесена капля раствора FeSO4. При наличии серебра в центре пятна возникает чёрная окраска Ag (металлическое серебро), а по краям красно–оранжевое кольцо Fe3+.
[Ag(NH3)2]Cl + FeSO4 + H2O ® Ag + Fe(OH)SO4 + NH4Cl + NH3.
ЦИНК Токсикологическое значение. Различные соединения цинка широко применяются в промышленности, сельском хозяйстве, быту, медицине. Токсикологическое значение имеют главным образом растворимые соли цинка, например цинка хлорид, применяемый в качестве консерванта древесины и входящий в состав так называемой паяльной жидкости, а также цинка фосфид.
Цинка сульфат используется в промышленности в качестве протравы при крашении тканей и в медицине в качестве прижигающего и дезинфицирующего средства. Цинка фосфид применяется в борьбе с грызунами и неоднократно был причиной отравления домашних птиц; отмечены случаи умышленного отравления этим препаратом людей. Известны также случаи «пищевых» отравлений солями цинка вследствие приготовления или хранения пищи, особенно кислой, в оцинкованной посуде.
Смертельных отравлений соединениями цинка (цинка фосфид является исключением) в литературе не описано. Благодаря быстро наступающей рвоте при приемах внутрь солей цинка смертельная, доза сравнительно велика. По Коберту она составляет для цинка хлорида около 5 г.
При остром отравлении солями цинка наблюдаются тошнота, упорная рвота, понос, судороги. Слизистые оболочки полости рта сморщены, белые. При хронических отравлениях среди рабочих, занятых выплавкой латуни, бронзы, разработкой цинковых руд, наблюдается вызываемая вдыханием цинка «цинковая», «латунная» или «литейная» лихорадка, выражающаяся в ряде признаков заболевания и в том числе в приступах озноба и повышении температуры до 37 - 40°.
Цинк, введенный в организм, накапливается в печени и поджелудочной железе. Соли цинка выводятся главным образом через желудочно-кишечный тракт, в меньшей степени - с мочой.
Цинк поступает в организм с пищей. Является широко распространенным элементом как в неживой природе, так и в растительных и животных организмах. В органах человека, по данным А. О. Войнара, наибольшие количества цинка содержатся (в пересчете на 100 г свежего материала) в печени (5,4 -14,5 мг), почках (5,5 мг), волосах (16,3 мг) и костях 10,09 мг.
Дробным методом обнаруживается 2,73 - 6,71 мг естественно содержащегося Zn2+ в 100 г почек и 1,76 - 6,16 мг в 100 г печени, что необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа.
Обнаружение цинка
При обнаружении цинка вначале проводят реакцию образования цинка дитизоната (основная реакция).
Хлороформный слой окрашивается в розово–фиолетовый цвет.
При положительном результате это реакции на цинк проводят подтверждающие реакции после выделения цинка из минерализата в виде диэтилдитиокарбамината с последующей реэкстракцией 1 моль/л раствором хлороводородной кислоты.
Водное извлечение отделяют, делят на три части и проделывают следующие реакции:
а) Реакция с калия гексацианоферратом (II)
ZnCl2 + K4[Fe(CN)6] Появляется муть или белый осадок.
б) Реакция образования цинка сульфида
ZnCl2 + H2S
Образуются осадок или муть белого цвета.
в) Реакция с аммония тетрароданомеркуратом
ZnCl2 + (NH4)2 [Hg(SCN)4] ® Zn[Hg(SCN)4] ¯ + 2 NH4Cl
Появляются кристаллы в виде дендритов или одиночных клинообразных кристаллов.
МЕДЬ Токсикологическое значение. Медь и ее соли широко применяются в промышленности. Для получения красок и в ситцепечатании используются CuO, CuCl2, Cu(NО3)2, СuСО3.Сu(ОН)2 (малахит), Cu(OCOCH3)2, Cu(OCOCH3)2.Cu(OH)2.H2О (ацетат меди основной - ярь-медянка). Сульфат меди CuSО4 применяется, кроме того, в гальванопластике, для пропитки дерева, в производстве чернил; ряд соединений меди используется в сельском хозяйстве в качестве инсектофунгицидов, например CuO, CuCl2, Cu2(OCl)2, CuSО4, CuCО3.Cu(OH)2 (последнее соединение известно под названием препарата АБ). В медицине применяются сульфат меди CuSО4. 5H2О и цитрат меди Си2С6Н4О7. 2,5Н2О.
Токсикологическое значение соединений меди невелико. Смертельной дозой сульфата меди считают 10 г.
Отравления медью в большинстве случаев являются комбинированными (медью и свинцом, медью и цинком и т. п.). При химико-токсикологических исследованиях имеет значение одновременное нахождение в объекте исследования Сu2+ и As2О5 что указывает на возможность отравления швейнфуртской (парижской) зеленью - Cu(OCOCH3)2-3Cu(AsО2)2, зеленью Шееле - Cu2AS2О5 и другими препаратами меди и мышьяка, применявшимися в сельском хозяйстве в качестве инсектофунгицидов. Объектами химико-токсикологического исследования могут оказаться рвотные массы и различные пищевые продукты, в которые медь попадает в результате приготовления пищи в плохо луженой посуде, варки в медном тазу с последующим оставлением в нем охлажденного варенья и т. п.
Широкое распространение меди в природе ведет к нахождению меди во многих растениях, например в семенах бобовых растений; медь находится и в печени, а также во внутренних органах трупов людей, особенно пожилых.
Все это указывает на особую необходимость в случае нахождения меди производить количественное определение, чтобы дать возможность судебно-медицинским экспертам и суду решить, является ли найденная медь естественной составной частью данного объекта, например зеленого горошка, внутренних органов трупа и т. д., или введена умышленно (для окраски консервов или других целей).
А. Н. Крылова определяла дробным методом медь в 100 г печени в пределах 0,56 - 1,12 мг; в почках 0,25 - 0,40 мг и в головном мозге 0,31 - 0,34 мг. Эти количества меди при судебно-медицинской оценки результатов химико – токсикологического анализа должны рассматриваться как естественно содержащиеся количества.
Обнаружение меди
Обнаружение меди основано на избирательной экстракции её из мине-рализата в виде диэтилдитиокарбамината меди с последующей реэкстракцией 1 % раствором сулемы.
Водный слой отделяют от хлороформа, делят на три части и проделывают следующие подтверждающие реакции:
а) Реакция образования меди цинкатетрародано - меркурата
CuCl2 + 2 (NH4)2[Hg(CNS)4] + ZnSO4 ®
® Cu Zn [Hg(CNS)4]2 ¯ + 2 (NH4)Cl + (NH4)2SO4
В присутствии меди выпавший осадок окрашивается в лилово–розовый цвет.
б) Реакция образования меди - кадмия гексацианоферрата
CuCl2 + CdCl2 + K4[Fe(CN)6] ® Cu Cd [Fe(CN)6] ¯ + 4 KCl
В присутствии меди выпавший осадок окрашивается в сиреневый цвет.
в) Реакция образования пиридинроданидного комплекса меди
В присутствии меди хлороформ окрашивается в изумрудно–зелёный цвет.
ВИСМУТ Токсикологическое значение. Металлический висмут применяется в промышленности для получения сплавов с низкой температурой плавления. Соли висмута применяются в фотографии для изготовления косметических мазей и медицинских препаратов [BiOCI, Bi(NО3)s.5H2O, Bi(NО3)3-Bi(OH)3], светящихся со ставов [Bi(NО3)3-5H2О], в производстве хрустального стекла Bi2О3. Медицинскими препаратами висмута являются нитрат основной висмута и органические соединения висмута.
Ядовитыми свойствами обладают легко растворимые соединения висмута, применяемые в терапевтической практике в качестве противосифилитических или рвотных средств. Однако и трудно растворимые соли висмута под влиянием соляной, молочной и других органических кислот образуют легко растворимые комплексные соединения висмута, всасывающиеся в кишечнике. При введении в кровь комплексных солей наблюдались отравления висмутом. Всосавшийся висмут долго задерживается в организме, преимущественно в печени, почках, селезенке, легких, в ткани мозга, и может быть обнаружен в них по прошествии длительных сроков после его введения. Выделение висмута происходит через почки, слизистые оболочки желудочно-кишечного тракта и через потовые железы. Выделяясь потовыми железами, препараты висмута могут вызывать кожный зуд и быть причиной дерматитов.
В следах (цифровые данные в литературе отсутствуют) висмут обнаружен в органах людей как естественно содержащийся элемент.
Дробным методом естественно содержащийся висмут в печени трупа человека не определяется.
Обнаружение висмута
1. Реакция с 8–оксихинолином (основная реакция)
Bi3+ + 4 KI ® [BiI4]– + 4 K+
При добавлении к образовавшемуся осадку 1 мл смеси ацетона и этилацетата (1: 1) и последующем встряхивании осадок растворяется в органическом растворителе, окрашивая последний в цвета от жёлтого до малинового.
При наличии ионов висмута появляется лимонно–жёлтое окрашивание
раствора.
В случае положительного результата этих двух реакций висмут экстрагируют из минерализата в виде ДДТК–висмута.
Хлороформное извлечение отделяют, промывают водой и встряхивают с 1 мл концентрированной кислоты азотной. Азотнокислый реэкстракт отделяют и делят на 2 части, производят реакции:
а) Реакция с цезия хлоридом и калия йодидом (микрокристаллическая) Образуются оранжевые кристаллы в виде многоугольников и шестилучевых звёздCs [BiI4].
б) Реакция с калия бромидом и бруцином (микрокристаллическая)
Образуются зеленоватые игольчатые кристаллы в виде сфероидов.
[C23H26N2O4H] [BiBr4].
КАДМИЙ Токсикологическое значение. Кадмий широко применяется в различных отраслях промышленности: для получения легкоплавких сплавов, изготовления электродов щелочных аккумуляторов, кадмирования, производства кадмиевых ламп, в фотографии, ювелирном деле. Кадмием заменяют олово для посуды или висмут в типографском шрифте и др.
Металлический кадмий при плавке и окись кадмия ядовиты. Кадмированная посуда может быть источником отравлений вследствие растворимости кадмия в кислых пищевых продуктах. Описаны случаи отравлений как производственного, так и бытового характера.
Соли кадмия, попавшие в желудочно-кишечный тракт, вызывают воспаление почек, жировое перерождение печени и сердца, кишечные кровотечения. Накапливается Cd2+ главным образом в печени и почках.
Смертельная доза солей кадмия, принятых через рот, для человека не установлена.
Предельно допустимая концентрация кадмия в воздухе составляет 0,0001 - 0,001 мг/м3. Количества аэрозоля окиси кадмия, равные 2500 - 2900 мг/м3, являются смертельными.
Из организма кадмий выводится очень медленно. Он постоянно встречается в растительных и животных организмах и является микроэлементом. В органах человека кадмий является естественно содержащимся элементом и постоянно обнаруживается и определяется при химико-токсикологическом анализе внутренних органов трупа человека. Т. М. Моисеева определяла естественно содержащийся кадмий в почках (0,31- 2,92 мг) и печени (0,21 - 0,42 мг) трупа человека даже при систематическом сероводородном методе анализа. Дробным методом определяется 0,64- 6,68 мг Cd2+ в 100 г печени и 1,32 - 8,48 мг Cd2+ в 100 г почек человека. Эти количества Cd2+ необходимо учитывать при судебно-медицинской оценке результатов химико-токсикологического анализа как естественно содержащиеся.
Обнаружение кадмия
Наличие кадмия подтверждают после выделения его из минерализата в виде кадмия диэтилдитиокарбамината с последующей реэкстракцией его 1 моль/л кислотой хлороводородной.
Реэкстракт используют для проведения следующих реакций.
1. Реакция образования кадмия сульфида
CdCl2 + Na2S
Образуется муть или осадок канареечно–жёлтого цвета.
2. Реакция образования кадмия ферроцианида
2 CdCl2 + K4[Fe(CN)6]
Появляется муть или осадок белого цвета.
При положительном результате этих реакций проводят микрокристаллические реакции:
а) Реакция с бруцином и натрия бромидом
В присутствии кадмия образуются бесцвет-ные призматические кристаллы в виде сфероидов:[C23H26N2O4H]2 [CdBr4].
б) Реакция с пиридином и калия бромидом
Появляются бесцветные призматические кристаллы в виде сфероидов:[C5H5N H]2 [CdBr4].
РТУТЬ Токсикологическое значение ртути
Металлическая ртуть, а также ее соли имеют широкое и разнообразное применение в производстве люминесцентных, кварцевых и радиоламп, при изготовлении контрольно-измерительных приборов, ртутных выпрямителей, ртутных насосов. Широко используется при электролитическом способе получения хлора, калибровании химической посуды, извлечении золота и серебра из руд и для многих других солей. Из солей ртути особенно широкое применение имеет сулема, несколько меньшее – ртути нитрат, ртути сульфид, сулема, ртуть йодная и др. Широкое применение ртути и ее производных в промышленности и сельском хозяйстве делает возможным соприкосновение с ними довольно большого круга людей. Поэтому могут создаваться условия для отравления (профессиональные, медицинские, бытовые в связи с ошибочными приемами соединений ртути внутрь, при вдыхании паров ртути или ее препаратов, при передозировках и т. п.).
Характер и течение ртутных отравлений различны и зависят от способа введения ртути в организм. Пары ртути, попадая в организм через органы дыхания, поражают прежде всего, центральную нервную систему, в первую очередь кору головного мозга. Специфическое действие ртути обусловлено связыванием белковых сульфгидрильных групп, что приводит к нарушению клеточного дыхания и преципитации белков. В случаях отравления солями ртути, принятыми per os, в основном поражаются желудочно-кишечный тракт и почки, а также печень и слюнные железы, т. е. органы, через которые ртуть выделяется. При отравлении солями ртути ощущаются металлический привкус во рту, жгучие боли в пищеводе и желудке, наблюдается рвота и кровавый понос. Смертельной дозой сулемы или других растворимых солей ртути при введении в желудок считают 0,2 - 0,3 г. При внутривенном введении эта доза примерно в 2 раза меньше.
Продолжительность течения ртутной интоксикации различна. Смерть обычно наступает через 5-10 суток и позже. Из организма ртуть выводится с мочой, калом, а также железами: слюнными, потовыми, молочными и др. Выделение ртути протекает медленно. Через 2 недели после введения часть введенного количества ртути еще остается в организме.
Летальность при отравлениях препаратами ртути высокая. При отравлениях хлоридом окисной ртути она составляет 60 - 84%. В качестве противоядий при отравлениях ртутными препаратами применяют унитиол (2,3-димеркаптопролан-сульфонат натрия), и венгерский препарат дикаптол.
Ртуть откладывается в печени, почках, меньше в других органах и тканях. Она может быть обнаружена в человеческом организме и в норме.
При исследовании дробным методом печени и почек 71 трупа естественное содержание ртути в -печени определялось в пределах 0- 0,001 мг, а в почках - 0,04 мг в 100 г органа. Наибольшие количества естественно содержащейся ртути обнаруживаются в почках, несколько меньше в печени и других органах. Как естественное содержание определялось 2,4 мкг в 200 мл мочи.
Диагноз отравления соединениями ртути затруднен. Острое отравление часто принимают за желудочно-кишечное расстройство. Самым достоверным способом является химическое обнаружение и определение ртути в моче, рвотных массах, экскрементах, слюне.
Патологоанатомическая картина может дать наводящие указания лишь при типичных изменениях внутренних органов: от покраснения и набухания слизистых оболочек пищевода или желудка до некроза в виде белого или серого струпа, изменения в толстой кишке и нижних отделах тонких кишок от геморрагически-серозного воспаления до некрозов с образованием язв.
В случаях, когда отравление длилось от 5 до 14 дней, типичную картину сулемового нефроза представляют почки. Для заключения о смерти от ртутного отравления судебно-медицинскому эксперту и судебно-следственным органам существенную помощь оказывают данные химико-токсикологического анализа.
Органические препараты ртути
В последние годы широкое применение в народном хозяйстве приобрели органические соединения ртути, например этилмеркурхлорид, фенилмеркурацетат, фенилмеркурбромид и др.
Этилмеркурхлорид C2H5HgCl представляет собой белый порошок с температурой плавления 192,3° и специфическим запахом. В воде практически нерастворим, хорошо растворим в горячем спирте и 10% растворе едкого натра.
Изолирование ртутьорганических соединений из внутренних органов трупа, мочи, крови, объектов растительного происхождения (зерно) при химико-токсикологическом анализе основано на извлечении их 3 - 9 М. раствором кислоты соляной, экстракции хлороформом, качественном обнаружении и количественном (спектрофотометрическом) определении в виде этилмеркурдитизоната.
Токсикологическое значение органических препаратов ртути обусловлено как широким применением ртутьорганических соединений, так и очень высокой токсичностью их.
Многие ртутьорганические соединения, в том числе этилмеркурхлорид и препараты на его основе, широко используются в сельском хозяйстве для предпосевной обработки (протравливания) семян зерновых и других культур.
Ртутьорганические препараты применяются для пропитки стройматериалов в целях консервирования, для предохранения альбуминовых и казеиновых клеев от плесневых грибов.
В медицине некоторые ртутьорганические соединения используются в качестве диуретиков, для стерилизации инструментов, при обработке поверхности ран, в качестве противораковых средств.
В химических лабораториях с их помощью получают органические производные других элементов, решают важные теоретические проблемы химии.
По токсичности органические препараты ртути превосходят препараты неорганические. Симптомы отравления при действии органических препаратов ртути на организм не зависят от пути введения их и характеризуются острым поражением центральной нервной и сердечно-сосудистой систем.
Более высокая токсичность органических препаратов ртути объясняется тем обстоятельством, что органический радикал способствует проникновению их в липоиды мозга, что приводит к тяжелому поражению центральной нервной системы.
Клиническая картина отравлений органическими препаратами ртути не всегда характерна. Симптомы отравления часто затягиваются и напоминают желудочно-кишечные заболевания, что иногда приводило к постановке неправильного диагноза (пищевое отравление, дизентерия, туберкулезный менингит, глистная интоксикация, брюшной тиф, вирусный грипп и др.), к неправильному лечению и невозможности принять своевременные меры по спасению жизни пострадавшего. Большую помощь в диагностике отравления оказывает своевременно сделанный анализ мочи больного.
Органические препараты ртути обладают кумулятивными свойствами, долго задерживаются в организме и особенно в ткани мозга, и медленно выводятся из него. Опытами на курах и крысах было установлено, что ЭМХ хорошо всасывается из пищеварительного тракта, практически не разрушается, накапливается в печени и других жизненно важных органах, медленно и равномерно выделяется почками; с каловыми массами выделяются меньшие количества его, чем при введении неорганических препаратов ртути. Одним из путей выведения органических производных ртути являются волосы (шерсть).
Патологоанатомическая картина не всегда выявляет отравление препаратами ртути, иногда скорее напоминает отравление мышьяком, а потому судебно-медицинские эксперты для заключения о причинах смерти при подозрении на отравление ртутными препаратами обращаются к химико-токсикологическому исследованию.
Определение ртути
При изолировании ртути из биологического материала общими методами минерализации потери её за счёт улетучивания в условиях высоких температур могут достигать более 90 %. В связи с этим, проводят только частичное разрушение органических веществ, или так называемую деструкцию.
По 20 г средней пробы печени и почек раздельно (исследование смеси органов не допускается) помещают в две колбы ёмкостью 200 мл. В каждую колбу приливают 5 мл воды, 1 мл этанола, 10 мл кислоты азотной концентрированной.
К смеси добавляют по каплям 20 мл кислоты серной концентрированной с такой скоростью, чтобы постоянно поддерживать реакцию разложения кислоты азотной, но окислы азота не выделялись из колбы. Колбу оставляют при комнатной температуре на 5 – 10 мин до прекращения выделения окислов азота, затем нагревают на кипящей водяной бане в течение 10 мин. При бурном течении реакции в колбу добавляют 30 – 50 мл воды. Горячий деструктат смешивают с двойным объёмом горячей воды и, не охлаждая, фильтруют через двойной предварительно увлажнённый фильтр в колбу, содержащую 20 мл насыщенного раствора мочевины (для связывания окислителей).
O = C (NH2)2 + 2 HNO3 ® N2 + 2 NO + CO2 + 3 H2O
O = C (NH2)2 + 2 HNO2 ® 2 N2 + CO2 + 3 H2O
Фильтр и остатки жира промывают 1 – 2 раза горячей водой. Промывные воды объединяют с деструктатом. После охлаждения жидкость разбавляют водой в мерной колбе на 200 мл и определяют ртуть.
Для обнаружения ртути в деструктате применяют реакции с дитизоном и с взвесью меди (I) йодида. Реакцию с дитизоном также применяют для фотоколориметрического определения ртути, а реакцию со взвесью меди (I) йодида используют и для визуального нефелометрического определения ртути в деструктате.
1.Реакция с дитизоном
Фотоэлектроколориметрическое определение ртути (
в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
в CCl4_ зеленый цвет в CCl4_ оранжевый цвет
2. Реакция с меди (I) йодидом
Выделение ртути из деструктата проводится с использованием йодида меди (I):
Hg2+ + 4 CuI ® Cu2[HgI4] ¯ + 2 Cu+
белая розовая
взвесь взвесь
Для полного осаждения ртути вводят избыток CuI. Колориметрическое определение проводят после проведения ртути из осадка Cu2[HgI4] в растворимый комплекс К2[HgI4]
Cu2[HgI4] + 2КI/I2
В присутствии ионов ртути взвесь окрасится в розовый или красный цвет.
СУРЬМА Токсикологическое значение В промышленности различные препараты сурьмы Sb2О5; Sb2S5 - применяются при изготовлении эмалированной по гончарных изделий, стекла, текстильных и резиновых предметов огнеупорных тканей, брезента и в других отраслях. Ряд препаратов сурьмы, как, например, пятнистая сурьма, сурьмин, стибенил, неостибозан, солюсурьмин и др., используются в медицине.
Описаны случайные медицинские, пищевые, производственные и даже умышленные отравления препаратами сурьмы.
Клиническая картина отравления сурьмой сходна с клиникой отравления соединениями мышьяка. Смертельная доза тартрата антимонилкалия для человека при введении через рот составляет ~ 150 мг.
При патологоанатомическом исследовании трупа отмечаются гиперемия легких, расстройство кровообращения, кровоизлияния в легких и органах желудочно-кишечного тракта.
Опытами на животных установлено, что сурьма может накапливаться в почках и главным образом в печени. По дани А. О. Войнара, в органах человека и млекопитающих сурьма естественно содержащийся элемент не обнаружена.
Обнаружение сурьмы
1. Реакция с малахитовым зеленым (основная реакция)
Эта реакция основана на том, что малахитовый зелёный (равно как и бриллиантовый зелёный), являющийся основным красителем, образует с ацидокомплексом сурьмы ионный ассоциат, который экстрагируется толуолом, окрашивая его в синий или голубой цвет.
Сурьма, находящаяся в минерализате в степени окисления 3+, окисляется натрия нитритом до степени окисления 5+ и с кислотой хлороводородной даёт ацидокомплекс, который и вступает в реакцию.
HSbO2 + NaNO2 + HCl ® HSbO3 + NO + NaCl + H2O
HSbO3 + 6 HCl ® HSbCl6 + 3 H2O
В присутствии сурьмы слой толуола окрашивается в сине–голубой цвет, а водный слой – в оранжевый. Толуольное извлечение отделяют, вс
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 714; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.208 (0.014 с.) |

 ® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4
® H2Cr2O7 + 3 (NH4)2SO4 + 6 H2SO4










 K2Zn3[Fe(CN)6]2 ¯ + 4 KCl
K2Zn3[Fe(CN)6]2 ¯ + 4 KCl







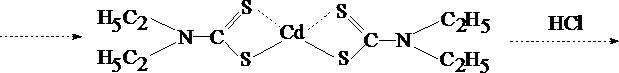

 CdS ¯ + 2 NaCl
CdS ¯ + 2 NaCl

 = 485 нм) по одноцветной окраске дитизоната ртути проводится после непосредственной экстракции его из деструктата четыреххлористым углеродом
= 485 нм) по одноцветной окраске дитизоната ртути проводится после непосредственной экстракции его из деструктата четыреххлористым углеродом
 К2[HgI4] + 2 CuI
К2[HgI4] + 2 CuI



