Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм осуществления перфорин-зависимой цитотоксичностиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте · Имеются два основных пути реализации клеточной цитотоксичности: перфорин-зависимый и Fas-зависимый. · Цитотоксические Т-лимфоциты (CД 8+) проявляют свою цитотоксичность, задействуя оба механизма; NK-клетки (CД 56) используют исключительно перфорин-зависимый механизм. · Перфорин-зависимый механизм реализуется после распознавания антигена клетки-мишени Т-клеточным рецептором, что приводит к запуску и пространственной организации последующих процессов, включающих: - создание прочного контакта Т-киллеров и клеток-мишеней при участии вспомогательных молекул адгезии, прежде всего, LFA (связанных с функцией лимфоцитов) и ICAM-1 (экспрессируемых клетками-мишенями); - реорганизацию цитоплазматических гранул и компонентов цитоскелета (актина и тубулина) Т-лимфоцитов; - экзоцитоз содержимого гранул в зону межклеточного контакта; - активацию (при обязательном участии ионов кальция) освободившегося из гранул перфорина; - полимеризацию молекул перфорина (около 20 молекул), формирующих пору в мембране клетки-мишени; - проникновение в клетку-мишень через образовавшуюся пору белков - гранзимов, представляющих собой сериновые протеазы; - непосредственную активацию гранзимами каспаз; - запуск сигнального пути, приводящего к развитию апоптоза. · Таким образом, специфическая особенность развития перфорин-зависимого апоптоза - не типичное для этого процесса первичное повреждение мембраны клеток-мишеней. ЦИТОТОКСИЧЕСКИЕ Т-ЛИМФОЦИТЫ (Р.М. Хаитов с соавт., 2000) · Антигенспецифическая цитотоксичность обеспечивается дифференцированной субпопуляцией CD8+ Т α β - лимфоцитов: ЦТЛ. Рецептор этих лимфоцитов распознает антиген в комплексе с молекулами MHC-1 на мембране клеток-мишеней, что является необходимым условием для киллерной атаки ЦТЛ. · Главное защитное предназначение ЦТЛ - санация организма от внутриклеточных инфекций. · Неиммунные зрелые ЦТЛ 8+ имеют только программу для биосинтеза эффекторных молекул (цитотоксинов), которая начинает реализовываться после вовлечения их в иммунный ответ. Для этого лимфоциту недостаточно только связать распознаваемый антиген в комплексе с молекулой МНС на той или иной клетке. Требуются также и молекулы костимуляции. Если опухоль растет не из профессиональных антигенпредставляющих клеток, то этих молекул костимуляции на опухолевых клетках нет. И за фактом распознавания лимфоцитом (в тех случаях, когда есть что распознавать) не следует иммунный ответ, пока профессиональные антигенпредставляющие клетки не процессируют опухольспецифичные антигены. Обычно условия для этого отсутствуют. · В том случае, когда ЦТЛ 8+ вовлекаются в иммунный ответ в них происходит синтез de novo определенных веществ, которые в виде функционально неактивных молекул-предшественников накапливаются в гранулах. Эти гранулы сориентированы в связи с TCR, чем обеспечивается возможность строго локального киллерного удара по клетки-мишени. · Цитотоксины гранул ЦТЛ как минимум представлены двумя белками: перфорином и гранзимами (сериновыми протеазами), организующими сигнал на апоптоз для клетки-мишени. · Собственно механизм киллинга при участии ЦТЛ состоит в том, что связывая своим TCR антиген на поверхности клетки-мишени, ЦТЛ в области этой связи быстро формируют межклеточный интерфейс - локальную зону контакта с последующим выбрасыванием содержимого гранул. · В отличие от NK, ЦТЛ обладают еще одним механизмом индукции апоптоза клеток-мишеней, опосрдуемым регуляторным (Fas-зависимым) механизмом. Это связано со способностью активированных ЦТЛ (CD8+) экспрессировать на своей поверхности Fas-лиганд (Fas-L). · При осуществлении киллинга не повреждаются ни сами ЦТЛ, ни здоровые клетки тканей организма. ЦТЛ разрушают только пораженные клетки, на которых экспрессированы антигены вирусов или других внутриклеточных патогенов. · В ряде случаев опухолевые клетки проявляют сильную иммуносупрессорную активность, продуцируя некоторые цитокины. Наиболее известный из них - TGF-β. · Антитела к опухольспецифичным антигенам в большинстве случаев рост опухолей не угнетают. Напротив, они вызывают модуляцию антигенов на поверхности клетки.
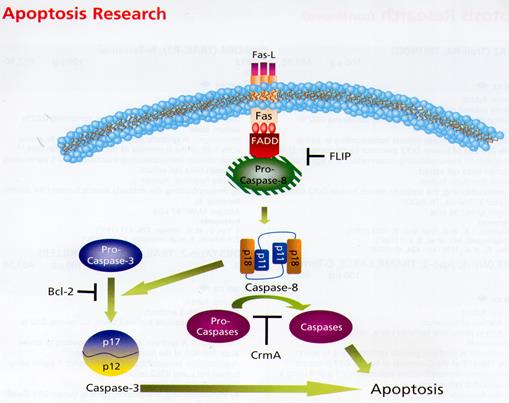
СХЕМА РАЗВИТИЯ FAS - ЗАВИСИМОГО АПОПТОЗА Cell Signaling & Neuroscience. Sigma 2000/2001 Fas - рецептор (CD-95, АРО-1) локализуется на клетках различных типов спонтанно (на гепатоцитах, кортикальных тимоцитах и т.д.) или после активации (зрелые лимфоциты). Он относится к большому семейству рецепторов фактора роста нервов, которое включает также рецепторы фактора некроза опухоли (ФНО) - TNFR1, мембранные молекулы CD40 и СD30 и др. Мм Fas- рецептора 36 кД. Для него пока не установлено других функций, кроме передачи сигнала к развитию апоптоза с помощью цитоплазматического домена смерти, которым он обладает (аналогичным доменом обладает и TNFR1). Естественным лигандом Fas - рецептора и источником сигнализации, приводящей к развитию апоптоза, является Fas - лиганд (Fas - L) - молекула с Мм 46 кД, гомологичная ФНО, CD40L и ряду других молекул, служащих лигандами для семейства рецепторов фактора роста нервов. На мембране Fas - лиганд представлен преимущественно тримерной формой. В случае Fas- зависимого апоптоза связывание Fas - лиганда с тримерным Fas - рецептором приводит к конформационным изменениям в цитоплазматическом домене смерти Fas - рецептора, что создает возможность его связывания с аналогичным доменом адапторной молекулы FADD (Fas-associated death domain), а затем - с таким же доменом белка RIP (Receptor interacting protein; на схеме отсутствует). Образующийся комплекс связывает прокаспазу 8 и активирует ее при участии протеазы FLICE (FADD - like IL-1b - converting enzime; на схеме отсутствует). При этом гетеродимеры прокаспазы 8 (р11 и р18) объединяются в тетрамер. Активированная каспаза 8 активирует (расщепляет) девять последующих прокаспаз, т.е. запускает каспазный каскад, в котором принимает участие и каспаза 3, ведущий к апоптозу. Аналогичные события происходят и при действии ФНО через рецептор TNFR1. Только в этом случае с доменом смерти рецептора взаимодействует адапторный белок TRADD (TNFR - associated death domain), с которым связываются FADD и RIP. Fas - индуцированный апоптоз может быть блокирован на нескольких уровнях. Во-первых, на уровне активации прокаспазы 8 с помощью особого клеточного белка FLIP (FLICE - inhibitory protein), который, как следует из его названия, инактивирует FLICE и, тем самым - блокирует активацию прокаспазы 8. Апоптоз может быть заблокирован при участии антиапоптотического белка Bcl-2 на этапе превращения прокаспазы 3 в каспазу 3. Наконец, он может быть заблокирован и белком вирусного происхождения, т. н. модификатором цитокинового ответа (Cytokine response modifier A - Crm A). Раздел XI.
|
|||||
|
Последнее изменение этой страницы: 2016-07-15; просмотров: 967; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.01 с.) |