Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Некоторые онкогены и онкосупрессорыСодержание книги
Поиск на нашем сайте (по Г.И. Абелеву, 1997)
Раздел V. МЕХАНИЗМЫ ОБЕСПЕЧЕНИЯ СТАБИЛЬНОСТИ КЛЕТОЧНОГО ГЕНОМА Общие положения Различают антиканцерогенные, антимутационные и антицеллюлярные механизмы противоопухолевой защиты (П.Ф. Литвицкий, 2002). Антиканцерогенные механизмы Обеспечивают торможение и/или блокаду проникновения канцерогенов в клетку и элиминации бластомогенных агентов из клетки и организма. Они включают: · физико-химическую фиксацию (глюкуронизация, сульфатирование) и удаление из организма (с мочой, экскрементами, желчью, потом) канцерогенов; · поглощение канцерогенов в процессе фагоцитоза, сочетающееся с их инактивацией и разрушением; · разрушение или инактивацию канцерогенов в клетках и биологических жидкостях в процессе их окисления, восстановления, диметилирования; · ингибирование («гашение») свободных радикалов и гидроперекисей факторами антиоксидантной защиты. Среди антиканцерогенных факторов особое место занимают механизмы, препятствующие действию канцерогенных вирусов, в том числе: · инактивация вирусов антителами; · ингибирование вирусов интерфероном; · обнаружение и разрушение вирусосодержащих клеток организма
Антимутационные механизмы Обеспечивают стабильность клеточного генома и препятствуют злокачественной трансформации клеток в условиях действия на них генотоксических факторов. Они включают: · стабильность ДНК как физико-химической структуры в условиях изменения рН, температуры, изоэлектрической точки и других воздействий; · комплементарность ДНК, исключающую возможность репликации некомплементарных нуклеотидов; · действие онкосупрессоров, обеспечивающих арест клеточного цикла и реализацию активных программ: а) репарацию ДНК с участием рестриктирующих эндонуклеаз; б) программированную клеточную гибель - апоптоз.
Антицеллюлярные механизмы Обеспечивают элиминацию трансформированных клеток. Они включают: · цитотоксические Т-лимфоциты (CD8+); · NK-клетки; · клетки моноцитарно-макрофагальной системы; · ФНО. СИСТЕМА РЕПАРАЦИИ ММR

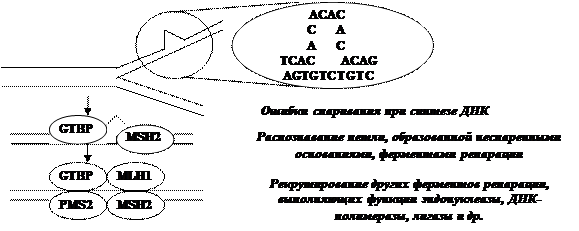
Механизм регуляции MMR (поА.В. Лихтенштейну, В.С. Шапоту, 2001)
· Инициация и прогрессия опухоли - суть фенотипические проявления нарушений генотипа (ДНК). В связи с этим противоопухолевая защита клетки осуществляется не только через механизмы супрессии клеточной пролиферации и активации апоптоза, но и путем репарации ДНК - восстановления нарушенной структуры. · Нарушения структуры ДНК могут быть следствием не только модификации или повреждения оснований и нуклеотидов, что характерно для действия физических и химических мутагенов. Они могут быть и результатом ошибок спаривания оснований, при которых вместо комплементарной пары нуклеотидов А+Т или Г+Ц в дочернюю цепь оказываются включенными нуклеотиды, некомплементарные нуклеотидам в материнской цепи ДНК. Эти некомплементарные нуклеотиды называют мисмэтчами (mismatch). · Возникновение подобных нарушений структуры ДНК возможно из-за ошибочной подстановки нуклеотида ДНК-полимеразой, чему способствует наличие в геноме многократных повторов 2-3 нуклеотидов, образующих т.н. микросателлитные последовательности. В геноме человека присутствует около 100.000 повторов ЦА/ГТ. При репликации таких локусов и возможен эффект скольжения(slippage), что приводит к образованию неспаренных участков, которые затрагивают только дочернюю нить ДНК. · Удаление подобных дефектов структуры ДНК - мисмэтч - репарация - прерогатива системы MMR (mutations in mismatch repair), которую обеспечивают несколько согласованно действующих белков. Одни из них (МSH2, GТВР) распознают дефект связывания с участками неспаренности и рекрутируют другие белки (МLН1, РМS2). Последние восстанавливают структуру дочерней нити ДНК, полностью комплементарную материнской нити. · При дефектах ММR возникает т. н. мутаторный фенотип. Частота мутаций возрастает в 100-1000 раз. Нестабильность микросателлитов охватывает весь геном и отражается на функционировании многих генов, в составе или вблизи которых расположены микросателлиты. · Неполноценность ММR резко увеличивает вероятность новых мутаций, которые, лавинообразно накапливаясь в ряду клеточных поколений, способствуют ускоренной прогрессии опухоли. Дефекты МLH1 и МSН2 обнаружены при различных семейных и спорадических формах рака, в частности, при раке толстой кишки. · Поскольку гены ММR относятся к числу генов-супрессоров, мутаторный фенотип возникает при инактивации обеих аллелей соответствующего гена. ГЕН p53 И ЕГО РОЛЬ В ОБЕСПЕЧЕНИИ СТАБИЛЬНОСТИ ГЕНОМА ПРИ ПОВРЕЖДЕНИЯХ ДНК
· Сенсором повреждения ДНК и нарушения в клеточном цикле является ген р53. Этот ген, располагающийся на коротком плече хромосомы 17, кодирует образование ядерного белка из 393 аминокислот с молекулярной массой 53 кД. Тетрамер р53 локализован в клеточном ядре и функционирует как транскрипционный фактор, связываясь своим карбоксильным окончанием со специфическими регионами генов-мишеней. Показано, что активация гена р53 происходит не только в ответ на поражение ДНК (под действием ионизирующего или УФЛ-облучения, ингибитора топоизомеразы 2 и прочих факторов), но может явиться следствием многих других процессов, происходящих в клетке, в том числе активации онкогенов, гипоксии, дефиците питания, старении и др. Недаром этот ген получил название "хранитель генома" (Е.Б. Владимирская, 2002). · При активации гена р53, кодируемый им белок р53 способен инициировать независимо друг от друга две программы (Н.Н. Белушкина, С.Е. Северин, 2001): а) временную остановку клеточного цикла в G1/S-фазе с помощью белка р21WAF1, ингибирующего циклинзависимые киназы; б) стимуляцию апоптоза путем активации генов Bax или Bid - проапоптотических генов семейства Bcl 2 и/или активации образования свободных форм кислорода, способствующих выходу цитохрома С из митохондрий. · Блок клеточного цикла в фазе G1 - фазе репликации ДНК, делает возможной репарацию поврежденной ДНК и предотвращает тем самым появление мутантных клеток. Считают, что приоритетной для большинства клеток является программа временной остановки митотического цикла, хотя выбор стратегии может характеризоваться тканеспецифичностью. · Есть данные об участии р53 в процессах репарации ДНК путем активации вновь открытого гена р53R2, кодирующего рибонуклеотидредуктазу. · Программа апоптоза включается при невозможности клетки репарировать ДНК во время "ареста" при прохождении митотического цикла, или дефиците белка р21WAF1. · Т.о., основной функцией гена р53 и кодируемого им белка (р53) следует считать защиту организма от накопления генетически дефектных клеток. Мутация гена р53 позволяет таким клеткам сохранять жизнеспособность в митозе, что чревато их выживанием и, следовательно, развитием опухолевого процесса. Такие мутации связаны с плохим прогнозом в лечении злокачественных новообразований, поскольку опухолевые клетки с этими мутациями оказываются резистентными к лучевой и химиотерапии. · Мутация гена р53 обнаруживаются более, чем в половине раковых опухолей. При длительной химиотерапии частота ее повышается. У детей мутация в гене р53 чаще наблюдается при остром Т-лимфобластном лейкозе, составляя около 12% и всегда служит прогностически неблагоприятным фактором.
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-15; просмотров: 518; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.10 (0.008 с.) |