
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические показатели качества воды ТемператураСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
СОСТАВ ПРИРОДНЫХ ВОД. Природные воды представляют собой сложные системы, содержащие растворенные вещества в виде ионов и молекул, минеральные и органические соединения в форме коллоидов, суспензий и эмульсий. В воде растворены газы, входящие в состав атмосферы, а также вещества, образующиеся в результате жизнедеятельности водных организмов и протекания процессов химического взаимодействия в самой водной среде. В качестве источников водоснабжения могут быть использованы подземные и поверхностные воды, в безводных районах - атмосферные осадки в виде дождя и снега. Состав поверхностных вод определяется климатическими и геоморфологическими факторами, почвенно-геологическими условиями; подземных - зависит от условий формирования залежи. Химический состав природных вод определяется: Главными ионами - натрий, калий, кальций, магний,сульфаты, карбонаты, хлориды, гидрокарбонаты (М составляет 1.5 и более г/ л); Растворенные газы - азот, кислород, углекислый газ, метан, сероводород, аммиак и др.; Биогенные элементы - соединения фосфора, азота, кремния; Микроэлементы - литий, рубидий, стронций, йод, бром, бор, цезий и др.; Органические вещества (150 мг/л и более); Состав мехпримесей природных вод определяется наличием глинистых, песчаных, гипсовых, известковых и коллоидных частиц (кремнекислота, гидроокись железа, гуматы и т.д.). Содержание взвешенных частиц в воде колеблется от нескольких единиц до десятков тысяч мг/л. Подземные воды характеризуются невысоким содержанием органических веществ но значительным уровнем минерализации (соли жесткости, железо, бор, марганец, бром, фтор), а иногда и растворенных газов. Кульским предложена классификация примесей воды на 4 группы: Примеси первой группы попадают в водоемы в результате эрозии почв, образуют в воде суспензии и эмульсии, кинетически неустойчивы,в состоянии покоя выпадают в осадок. Примеси второй группы представляют собой коллоидные частицы, ПАВы, вирусы, которые по своим размерам близки к коллоидным частицам. Примеси третьей группы - это молекулярно растворимые вещества. Примеси четвертой группы - это вещества, находящиеся в воде в ионном виде. Различают показатели качества воды: физические, химические, биологические, бактериологические. Физические показатели качества воды Температура Подземные источники - температура воды находится в пределах 8-12 град. Поверхностные источники - температура воды зависит от времени года, от поступления в них подземных вод, сбросов охлаждающей воды, изменяется от 0.1 до 30 градусов, оптимальная температура воды для х/п водоснабжения 7-11 градусов. Прозрачность, мутность и взвешенные вещества. Характеризуют наличие в воде частиц песка, глины, ила, планктона, водорослей. Мутность не должна превышать 1.5 мг/л. Цветность воды Обусловлена присутствием в воде гумусовых и дубильных веществ, белковых соединений, органических кислот и их солей, соединений железа и марганца, цветением водоема. Цветность воды измеряется в градусах платино-кобальтовой шкалы, для питьевой воды не должна превышать 20 градусов. Привкусы и запахи. Могут быть естественного и искусственного происхождения, различают 4 вкуса (соленый, горький, сладкий, кислый). Интенсивность и характер запахов и привкусов воды определяют органолептически по пятибальной шкале, допустимое значение привкусов и запахов определяется ГОСТом 2874- 42, при 20 градусах вкус и запах не должны превышать 2 баллов. Сухой остаток. Характеризует содержание в воде примесей в основном неорганического происхождения, прокаленный остаток показывает присутствие только неорганики. Согласно ГОСТ 17.3.03- 77 сухой остаток в воде природного источника не должен превышать 1 г/ л. Величина сухого остатка нормируется в производстве кино- и фотопленки, производствах органического синтеза, для питательной воды паровых котлов и т. д.
ИОННАЯ СИЛА РАСТВОРА. ЭЛЕКТРОПРОВОДНОСТЬ. Важнейшая физико-химическая характеристика солевого состава обрабатываемой воды и методов обработки.
Химические показатели качества воды
Активная реакция среды - является показателем кислотности или щелочности воды. По показателю рН природная вода подразделяется на кислую рН = 1 - 3; слабокислая рН = 4 - 6; нейтральная рН =7; слабощелочная рН =8-10; щелочная рН =11 — 14; Природная вода как правило имеет рН = 6.5 -8.5, что соответствует требованиям ГОСТа на питьевую воду. Перманганатная окисляемость воды - показывает количество кислорода необходимое для окисления легко окисляемых органических примесей в присутствии сильного окислителя (перманганата калия). Артезианские воды, ПО = 2 мг О2 / л; грунтовые воды, ПО = 5 - 8 мг О2/ л; реки, ПО = 40 - 60 мл О2 / л; болотные воды, ПО = 400 мг О2 / л. Бихроматная окисляемость - количество кислорода, необходимое для окисления всех видов загрязнений в кислой среде в присутствии бихромата калия. Биологическое потребление кислорода - количество кислорода необходимое для жизнедеятельности микроорганизмов, участвующих в окислении загрязняющих веществ.
Азотсодержащие вещества (аммоний, нитриты, нитраты) образуются в воде в результате разложения (окисления) белковых соединений под действием микроорганизмов. Повышенное содержание нитратов в воде приводит к нарушению окислительной способности крови. ПДК = 45 мг \ л.
Хлориды и сульфаты. Присутствуют во всех природных водах, являются причиной агрессивности воды по отношению к бетону (образование сульфата и хлорида кальция, растворимость которых в воде значительно выше, чем карбонатов). Присутствие в воде ионов хлора и сульфат - ионов в концентрациях, превышающих ПДК, приводит к нарушению функции желудочно - кишечного тракта. Щелочность воды. Обусловлена суммой содержащихся в воде гидроксильных ионов и анионов слабых кислот, определяет стабильность воды. Различают бикарбонатную, карбонатную и гидратную щелочность воды. Жесткость воды. Обусловлена присутствием в воде ионов кальция и магния, карбонатов и гидрокпрбонатов. Различают карбонатную, некарбонатную и общую жесткость воды. Присутствие в воде ионов кальция способствует укреплению костной ткани и выводу из организма ионов кадмия, избыток которых приводит к нарушению работы сердечно - сосудистой системы. Повышенная жесткость приводит к сложностям при эксплуатации систем водообеспечения, как промышленных предприятий, так и водоводов х/ п назначения (накипь, осадки на поверхности труб). Железо и марганец. Железо присутствует в воде в виде двух- и трехвалентных ионов, органических и неорганических коллоидов, комплексных соединений в форме тонкодисперсной взвеси, сульфида и гидроксида железа. Использование для питьевых целей воды с повышенным содержанием железа вызывает болезнь печени (гемосидерит). Избыток марганца придает воде окраску и вяжущий привкус, употребление воды с повышенным содержанием марганца приводит к заболеваниям костной ткани. Повышенные концентрации железа и марганца в воде промпредприятий способствуют развитию в ней железистых и марганцевых бактерий, продукты жизнедеятельности которых вызывают уменьшение сечения водопроводной аппаратуры (трудно растворимые осадки). Содержание железа и марганца строго нормируется для воды, используемой в текстильной, пищевой промышленности и в органическом синтезе. Соединения кремния встречаются в природных водах в форме органических и минеральных солей от десятых долей до нескольких мг в 1 л. Содержание кремния в питьевой воде не нормируется. Соединения фосфора встречаются в виде тонкодисперсных частиц минерального и органического происхождения, ионов ортофосфорной кислоты, растворенные формы фосфора в природной воде способствуют активному развитию флоры водоема - зарастанию, загниванию. В питьевой воде концентрация ионов фосфора не нормируется. Фтор. Является активным микроэлементом, влияющим на обмен веществ и формирование костной ткани человека, недостаток фтора в воде приводит к активному развитию кариеса, избыток - к флюорозу, поэтому содержание фтора в воде должно находиться в пределах 0.7 - 1.5 мг / л. Бор. В концентрациях превышающих ПДК ухудшает обмен веществ, вызывает заболевания печени и желудочно-кишечного тракта. ПДК - 0.5 мг / л. Бром. Повышенное содержание брома в питьевой воде снижает реакцию нервных окончаний на раздражение, отрицательно сказывается на функции печени и почек, способствует вымыванию калия из организма и увеличению азота в мочевине. ПДК =0.2 мг /л. Йод. Биологический микроэлемент, недостаток вызывает развитие болезни Дауна, снижению иммунитета, нарушению функции щитовидной железы (гипофункция), избыток - гиперфункция щитовидной железы. ПДК = 10 мг/л.
Растворенные в воде газы.
Углекислый газ. В зависимости от рН углекислота присутствует в воде в разных формах (растворенный газ, гидрокарбонат-ион, карбонат-ион). В зависимости от формы угольной кислоты в воде она может быть агрессивна по отношению к бетону, металлу или склонна к выделению карбоната кальция. Сероводород. Продукт распада органических соединений и растворения минеральных солей. В поверхностных водах присутствует в придонных слоях в незначительных количествах, в подземных - его содержание может достигать нескольких десятков мл / л. Наличие сероводорода в воде придает ей неприятный запах, вызывает коррозионное растрескивание труб, может вызывать активное развитие серобактерий, что приводит к зарастанию трубопроводов. В зависимости от рН воды сероводород может быть в трех формах: рН = 6,5 сероводородная кислота; рН = 6.5 - 12.5 гидросульфид-ион, рН= 12.5 - 14 сульфид - ион. Кислород. В артезианских водах кислород отсутствует, в поверхностных - его концентрация зависит от парциального давления в воздухе и температуры воды. Насыщение воды кислородом придает ей свежий вкус. Азот. В природные воды поступает из воздуха. Ионы аммонийного азота, нитраты и нитриты образуются в воде в результате разложения органических соединений под действием микроорганизмов. Метан. Присутствует в болотных водах, концентрация достигает 30 мг/ л. Гидробионты. Планктон - обитатели водоемов в толще воды; Бентос - обитатели на дне водоема; Нейсон - организмы, населяющие поверхностную пленку воды; Пагон - организмы, пребывающие зимой в толще льда в состоянии анабиоза. Гидрофлора. Определяется макро - и микрофитами. Макрофиты - высшая водная растительность, микрофиты - водоросли (зеленые, сине-зеленые, эвгленовые, диатомовые). МЕТОДЫ И ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ ВОДОПОДГОТОВКИ
Кондиционирование воды представляет собой комплекс физических, физико-химических и биологических методов обработки воды, способствующих улучшению ее качества. Все разнообразные функции, возлагаемые на очистные сооружения, могут быть сведены к следующим: Осветление - удаление взвешенных веществ, снижение мутности воды; Обесцвечивание - устранение растворенных веществ, придающих воде окраску; Обеззараживание - уничтожение содержащихся в воде бактерий; Обессоливание - удаление растворенных солей; Умягчение - удаление ионов жесткости; Дегазация - удаление растворенных газов; Дезодорация - удаление привкусов и запахов; Стабилизация - обработка воды, предупреждающая коррозионную активность воды и вероятность карбонатных отложений на оборудовании. Обогащение воды - насыщение воды ионами, содержание которых ниже кондиционных концентраций. Обезжелезивание - удаление растворенного железа; Деманганация - удаление растворенного марганца. Решение всех поставленных задач перед проектированием очистных сооружений достигается правильным выбором технологической схемы
Реагентные и безреагентные. Обработка воды с применением реагентов требует значительных эксплуатационных затрат (реагенты, оборудование, электроэнергия) затраты на строительство ниже (земляные работы, размеры отстойников, территория под строительство), чем в безреагентных схемах. Эффективность очистки при использовании реагентов повышается, продолжительность обработки воды сокращается. Самотечные и напорные. В самотечных системах водоочистных сооружений вода протекает под действием силы тяжести. В напорных системах вода течет по водоочистным сооружениям закрытого типа под давлением, создаваемым насосами. Состав и технологическую схему работы самотечных систем представляют в виде высотной схемы в профиле основных сооружений водоочистной станции. ВЫСОТНАЯ СХЕМА Высотную схему начинают составлять с наиболее низко расположенного сооружения - резервуара чистой воды. При определении отметок уровней воды в элементах сооружений водоочистной станции за начальную принимают отметку поверхности земли площадки водоочистной станции, отметку наивысшего уровня воды в резервуаре чистой воды обычно назначают на 0,5 м выше отметки поверхности земли. Для предварительного построения высотной схемы можно принять потери напора: -контактная камера - 0.3- 0.5м; -устройство ввода реагентов 0.1-0.3м; - в микрофильтрах и барабанных сетках 0.4-0.6 м; - в гидравлическом смесителе - 0.5- 0.6м; - в механическом смесителе 0.1-0.2 м; и т. д.(стр.643). При проектировании очистных сооружений и привязке их, необходимо учитывать рельеф местности, глубину залегания грунтовых вод, максимальный уровень воды в водоеме в период паводка, возможность самотечного отвода сточных вод и осадка с очистных сооружений.
На высотной схеме должны быть показаны: 1) реагентное хозяйство 2) сооружения по обороту промывных вод 3) обработка осадка 4) отметки оси промывных насосов или днища промывной башни 5) отметки вакуум-насосов и насосов-дозаторов, воздуходувок.
Физико-химические основы коагулирования примесей. Самостоятельно. Природные поверхностные воды представляют собой коллоидные растворы, размеры частиц в которых приближаются к размерам молекул и имеют как правило отрицательный заряд. Коллоидные растворы характеризуются агрегативной устойчивостью и процесс их очистки является сложной задачей. Для укрупнения мелкодисперсных частиц, увеличения скорости их осаждения и способности задерживаться пористыми фильтрами применяют коагуляцию. Коагуляция - это процесс разрушения коллоидных частиц под действием электролита, электрического или магнитного полей, сопровождающийся укрупнением диспергированных частиц и сорбцией их на поверхности гидратированного электролита. Коагуляция завершается образованием хлопьев, видимых невооруженным глазом, и отделением их от жидкой среды. Различают два типа коагуляции: конвективная коагуляция(проходящая в свободном объеме) и контактная (в толще зернистой загрузки или в массе взвешенного осадка). 2. Строение коллоидной частицы. NaCl+AgNO3(изб)=AgCl+NaNO3
Заряд частицы положительный, AgCl адсорбирует только те ионы, которые образуют кристаллическую решетку и находятся в избытке.
Ag + – потенциал- образующие ионы NO3 - – противоионы адсорбционного и диффузионного слоев Заряженные частицы препятствуют росту кристаллов Противоионы диффузионного слоя ориентируют полярные молекулы решетки, создавая дополнительную сольватную оболочку.
ƺ – потенциал на границе адсорбционного диффузионного слоев
Коллоидная частица всегда заряжена, м ицелла - электронейтральна
NaCl(изб)+AgNO3=AgCl
Разрушение коллоидной частицы называется коагуляцией. Переход осадка в золь называется пептизацией При нагревании или замораживании, добавлении в воду электролита, воздействии электрического или магнитного полей происходит разрушение двойного электрического поля и нарушение агрегативной устойчивости частицы. Природная вода содержит гидрофильные и гидрофобные примеси. Гидрофильные примеси представлены в основном органическими веществами,содержащими в своем составе полярные группы (-ОН, -СООН). Эти группы гидратированы и поэтому агрегативно устойчивы. Обработка воды, содержащей органические вещества в растворенном или коллоидном состоянии электролитами приводит к нарушению агрегативной устойчивости раствора. Гидрофобные примеси в воде представлены частичками глины, песка, породы. Они лишены гидратных оболочек, но имеют двойной электрический слой, характерный для коллоидных частиц. На границе адсорбционного слоя термодинамический потенциал ( Величина рН, отвечающая этому состоянию( Для отрицательно заряженных частиц коагулирующими ионами являются катионы, а для положительно заряженных - анионы. Коагуляция коллоидных растворов, имеющих противоположно заряженные частицы, возможна при их взаимном перемешивании, т.к в этом случае происходит взаимная нейтрализация разноименно заряженных частиц, их агломерация и седиментация. Действие коагулянта в воде сопровождается следующими процессами: - гидролиз электролита, -разрушение коллоидной частицы, -сорбция загрязняющих веществ на поверхности гидролизованного электролита, -соосаждение хлопьев. Гидроксиды алюминия и железа имеют положительный заряд на грануле, что способствует сорбции отрицательно заряженных примесей воды.
Чем больше ионная сила раствора, тем меньше КОАГУЛЯНТЫ И ИХ ГИДРОЛИЗ
СОЛИ АЛЮМИНИЯ Наибольшее применение в качестве коагулянта получил сульфат алюминия, который получают путем обработки сырой или обожженной глины серной кислотой с последующей фильтрацией раствора, упаркой и кристаллизацией. В качестве коагулянтов используются также алюминат натрия и оксихлориды алюминия. Исходными продуктами для получения алюмината натрия и оксихлорида алюминия служат свежеосажденная гидроокись или окись алюминия. Первый коагулянт получают растворением этих продуктов в разбавленном гидроксиде натрия, второй - в разбавленной соляной кислоте. Иногда для получения оксихлорида алюминия используют хлористый алюминий, являющийся отходом алюминиевой промышленности.
СОЛИ ЖЕЛЕЗА Наиболее распространенным коагулянтом является хлорное железо FeCl2, которое может быть получено обработкой железного лома хлором или методом анодного растворения железа в растворах поваренной соли. Железный купорос Fe SO4 получают из растворов, образующихся при травлении металла или методом анодного растворения железа в растворе серной кислоты. Применение аэрации дает возможность получать соли железа вида Недостатком железного купороса является необходимость иметь для перевода двухвалентного железа в трехвалентное высокий щелочной резерв (рН = 9) или применять дополнительное хлорирование его растворов.
СОСТАВ ПРОДУКТОВ ГИДРОЛИЗА.
Al2(SO4)3+6H2O= 6Al2(OH)
По условиям равновесия:
Склады Для хранения реагентов устраивают склады на 15-30 суточный запас исходя из периода мах их расхода с учетом условий доставки. Высота слоя h=1,5-2 м; при механизации 2,5-3,5 м. Хранение реагента осуществляется в мешках, в бочках и баках. Площадь склада для хранения коагулянта определяют по формуле:
Склад кислот необходимо изолировать от остальных помещений, должен быть оборудован приточно-вытяжной вентиляцией.
Склады хлора и NH3 д.б. расположены в пониженных местах территории ОС (запас Оборудование складов кислот, хлора, NH3 должно соответствовать условиям хранения сильнодействующих и ядовитых веществ. Требования к организации хлорного хозяйства п.п.6.211,6.212 СниП.
Склад активированного угля оборудуют в отдельном помещении, пожароопасность класс В
Хранение NaCl – в жидком виде (Qсут>0,5mыс м3\сут.); Vбаков=1,5
Склад хранения ионообменных смол – объем рассчитывается с учетом потерь при регенерации загрузки всех катионитовых фильтров + загрузка одного фильтра и дополнительно по 1 загрузке слабо и сильноосновных анионитов.
Склад фильтрующих материалов: V= n ф· nр 0,1 Vф.загр + Vф.загр аварийного запаса на перегрузку 1 фильтра (при n
Для загрузки фильтров рекомендуется использовать водоструйные и песковые насосы, конвейеры. При отсутствии центральных поставок фильтрующего материала рекомендуется предусматривать специальный цех по подготовке фильтрующего материала. Фторсодержащие реагенты (Na2SiF6 в деревянных бочках), ПАА (любой флокулянт) хранят в заводской таре При использовании комовой извести предусматривается ее гашение и хранение в емкостях в виде теста с концентрацией 35- 40 %.
Лаборатории, диспетчерские и др. вспомогательные помещения планируются согласно СНиП (по табл.31, стр.45.) На генплане показывают блок основных в/о сооружений, служебный корпус, реагентное хозяйство, башню промывной воды, сооружения для обработки осадка, НС-I, хлораторную, склад хлора, РЧВ, котельную, место размещения песковой площадки. На генплане должны быть показаны трубопроводы с указанием диаметров исходной и фильтрованой воды, трубопроводы подачи и отвода оборотной воды, подачи реагентов, промышленная и х/б канализация, теплосеть, кабели и т.д. 3. Повторное использование промывной воды и обработка осадка. Обработка промывной воды Фильтр – песколовка – резервуар –усреднитель, очищенная вода направляется в голову процесса Обработка осадка Резервуары-отстойники – сгустители – накопители – площадки вымораживания или подсушивания осадка Возможно механическое обезвоживание и регенерация коагулянта. На участках обезжелезивания возможно получение Fe(OH)3 (охра) Количество резервуаров промывных вод не менее 2
Контактная коагуляция КК называется процесс прилипания микроскопических частиц примесей воды к микроскопическим частицам сорбента или поверхности зернистого материала под действием молекулярных сил притяжения. Сближение частичек происходит за счет броуновских сил в результате перемешивания или направленного действия мелких частичек относительно крупных. Особенности протекания процесса КК. 1. На процесс КК не влияют Т и Щ. 2. Чем выше концентрация крупных частиц взвеси по отношению к мелким тем интенсивнее процесс прилипания мелких частиц к крупным за счет снижения устойчивости мелких частиц в результате чего повышается скорость и полнота извлечения ВВ из раствора.
Эти особенности широко используются в разработке технологии или последовательности процесса коагулирования: 1. Дробное коагулирование 2. Прерывистое коагулирование 3. Рециркуляция осадка При осветлении воды в контактных осветлителях и фильтрах, в осветлителях со слоем взвешенной контактной среды эффект контактной коагуляции наблюдается особенно ярко. Коагуляция в слое зернистых материалов протекает полнее и с большей скоростью чем в свободном объеме. Оптимальную дозу коагулянта при дозировании его перед фильтрами устанавливают на основании кривой контактной коагуляции
Оптимальная доза принимается на 5-10% выше дозы оптимальной по графику.
При проведении коагуляции в слое зернистой загрузки отпадает необходимость в камерах хлопьеобразования, отстойниках и осветлителях. При прохождении окрашенных природных вод через массу осадка гидроксида с не полностью использованной адсорбционной емкостью улучшается осветление воды.
Вывод: применение контактной коагуляции позволяет сократить объем очистных сооружений, улучшить работу фильтров и снизить расход реагентов.
Al анод Процессу химического окисления (растворения) Al способствуют ионы-депассиваторы, находящиеся в воде, повышающие скорость движения жидкости по отношению к поверхности металла. В связи с этим выход Al по току может достигать 130-140% Электрохимическое растворение Al в воде (анодное растворение)
На Al катоде могут протекать реакции (в природной воде)
Восстановление органических соединений
Из перечисленных катодных процессов в природной воде имеет место в основном кислородная и водородная деполяризация. На Al катоде возможно прохождение реакции Al с водой.
В прикатодном слое повышается рН до 10,5-12 во время электролиза, что приводит к растворению окисной пленки Al2O3. В процессе электролиза на электродах возможны следующие явления: 1. Адсорбция органических и неорганических веществ, которые способны повышать или понижать скорость электрохимической реакции. 2. Выделение пузырьков газа H2, O2 способных переносить вещество из жидкости на поверхность – электрофлотация. На процесс растворения электродов влияют: 1. рН 2. солевой состав 3. t 4. состав электрода 5. плотность тока 6. частота смены полярностей 7. скорость движения воды в межэлектродном пространстве.
Зависимость работы электролизера от плотности тока имеет следующий характер: - повышение плотности тока приводит к повышению эффективности работы в связи с повышением рабочей поверхности электродов; - интенсивно используется объем электролизеров. Дальнейшее повышение плотности приводит к усилению поляризационных явлений и пассивации электродов,в результате чего растет напряжение и электроэнергия затрачивается на побочные процессы. Рекомендуемая плотность тока 0,5-20 мА/ Для предотвращения образования осадка на электродах рекомендуется менять их полярность, но это приводит к снижению выхода металла по току. Процесс активного окисления металла при электролизе осложняется пассивацией поверхности электрода. Для Al электрода:
Рост температуры приводит к растворению окисной пленки, активизации электрода, растворимости осадка на электроде.
1. Реагентное хозяйство В состав реагентного хозяйства входят а) склады для хранения реагентов в сухом виде или в виде концентрированных растворов б) и устройства для приготовления растворов необходимой концентрации
Для приготовления раствора коагулянта используют специальные установки, состоящие из растворных и расходных баков, а также воздуходувок для перемешивания раствора реагентов (барботаж), механическое перемешивание. Вместимость растворных баков определяют
Р=17% для неочищенного коагулянта.
Емкость расходных баков
Раствор коагулянта пропускают самотеком из растворных баков в расходные и разбавляют водой до соответствующей концентрации. Расходных баков должно быть не менее двух, растворных в зависимости от скорости растворения коагулянта, способа доставки и загрузки К. Растворные и расходные баки изготавливают из ж/б, а их внутренние стенки обкладывают кислотоупорным кирпичом или кислотоустойчивой плиткой. Смешение реагентов с водой
1. Критерий Кэмпа. Задачи для осуществления эффективной коагуляции: 1. быстрое распределение реагента в объеме. 2. обеспечение мах контакта коллоидных частиц с реагентом или продуктом его гидролиза. 3. увеличение времени жизни продуктов гидролиза.
I этап – образование хлопьев r =1-10 мкм, При плохом перемешивании возрастает расход реагентов и снижается степень очистки. Интенсивность смешивания реагентов с водой характеризуется критерием Кэмпа GT и градиентом скорости G
Е – энергия перемешивания
Т – продолжительность смешения V – объем жидкости в емкости G – градиент скорости G=200-300 с GT – критерий Кэмпа
С ростом G доза реагентов для оптимальной очистки снижается. Для обеспечения оптимальной скорости смешения реагенты следует вводить в точках максимальной турбулентности.
Смешение реагентов с водой происходит наиболее интенсивно при использовании реагентораспределителей – устройств для ввода реагентов. Различают реагентораспределители в виде перфорированных трубчатых систем, камерно-лучевого, диффузорного и струйного типов, размещаемых в подающих трубопроводах или в начале смесителя.
Реагентораспределители Перфорированный распределитель.
1- трубопровод отрабатываемой воды 2- заглушки 3- перфорированная лучевая распределительная трубка 4- подача реагента 5- разъемная штанга
Его устанавливают в трубе перед смесителем, непосредственно при поступлении воды в смеситель или в одном из отделений входной камеры смесителя.
Смесители По принципу действия различают 2 основных типа смесителей: гидравлические и механические. При выборе типа смесителя необходимо учитывать конструктивные особенности, компоновку производительность ОС и метод обработки воды. Расчет смесителя.
Число перегородок принимают равным 3. Диаметр отверстия Д=20-40 мм при Д=100 мм при Число отверстий
Суммарная площадь отверстий не должна превышать 30% рабочей площади перегородки, скорость движения воды в отверстиях Потеря напора при прохождении воды через отверстия в каждой перегородке:
Ширину лотка определяют по скорости движения в нем воды, которую принимают Найдя потерю напора h и задав глубину H в конце смесителя H=0,4-0,5м определяют уровень воды в начале смесителя. Недостатком работы является то, что при снижении расхода на станциях в дырчатых смесителях наблюдается неравномерность смешени
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 959; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.015 с.) |


 - поверхностный потенциал, возникает на границе твердой и жидкой фаз.
- поверхностный потенциал, возникает на границе твердой и жидкой фаз. +NaNO3
+NaNO3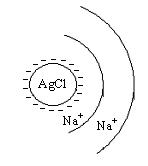 Заряд частицы отрицательный
Заряд частицы отрицательный ). При воздействии на коллоидную систему электрокинетический потенциал уменьшается и, при нулевом его значении наступает изоэлектрическое состояние коллоидной системы, коллоидный раствор разрушается.
). При воздействии на коллоидную систему электрокинетический потенциал уменьшается и, при нулевом его значении наступает изоэлектрическое состояние коллоидной системы, коллоидный раствор разрушается.

 система приближается к изоэлектрическому состоянию, что в свою очередь приводит к активной коагуляции.
система приближается к изоэлектрическому состоянию, что в свою очередь приводит к активной коагуляции. обладающие сильным коагулирующим действием.
обладающие сильным коагулирующим действием. +6H+ ; рН
+6H+ ; рН 

 - производительность ОС, м3/сут.
- производительность ОС, м3/сут. - расчетная доза коагулянта, мг/л
- расчетная доза коагулянта, мг/л - продолжительность хранения коагулянта, сут.
- продолжительность хранения коагулянта, сут. - коэффициент учета дополнительной площади (
- коэффициент учета дополнительной площади ( )
) - содержание вещества в безводном продукте,%
- содержание вещества в безводном продукте,% - допустимая высота хранения,м
- допустимая высота хранения,м - объемная масса коагулянта, кг/м3
- объемная масса коагулянта, кг/м3 100т; изолированные отсеки до 50т), помещение с двумя выходами с противоположных сторон. Хранят хлор в баллонах или контейнерах.
100т; изолированные отсеки до 50т), помещение с двумя выходами с противоположных сторон. Хранят хлор в баллонах или контейнерах. /на 1т реагента.
/на 1т реагента.

 - деполяризация мигрирующих ионов
- деполяризация мигрирующих ионов - в нейтральной среде деполяризация нейтральными молекулами
- в нейтральной среде деполяризация нейтральными молекулами - в кислой среде
- в кислой среде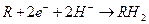
 - радикал органического соединения
- радикал органического соединения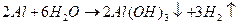

 расстояние между электродами 10-15 мм. Рабочее напряжение на электродах
расстояние между электродами 10-15 мм. Рабочее напряжение на электродах 
 - активизирует Al электрод.
- активизирует Al электрод. - пассивирует Al электрод
- пассивирует Al электрод
 =20-24%
=20-24% - часовой расход воды,
- часовой расход воды, 
 - плотность коагулянта; t – время, необходимое для приготовления раствора коагулянта
- плотность коагулянта; t – время, необходимое для приготовления раствора коагулянта
 =10-12%
=10-12% - концентрация раствора коагулянта в расходных баках.
- концентрация раствора коагулянта в расходных баках.

 - динамическая вязкость воды
- динамическая вязкость воды

 тыс.
тыс. 
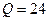 тыс.
тыс. 

 - коэффициент расхода, зависящий от отношения
- коэффициент расхода, зависящий от отношения  и принимается равным 0,65-0,75
и принимается равным 0,65-0,75 - толщина перегородки
- толщина перегородки



