
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимическая коагуляция.Содержание книги
Поиск на нашем сайте Электрокоагуляция – метод очистки воды в электролизере с растворимыми электродами. Скорость электрохимической реакции определяется: 1. величиной потенциала на границе раздела металл – раствор. 2. составом раствора 3. условиями диффузии компонентов или продуктов реакции в растворе.
В результате электролиза на электродах восстанавливаются или окисляются компоненты электролита. Количество металла, растворяющегося в воде в результате электролиза определяется по формуле:
Электро-химическое растворение металла включает 2 основные группы процессов: 1. растворение за счет внешнего тока (анодное) 2. химическое растворение, в результате взаимодействия металла с окружающей средой Al анод Процессу химического окисления (растворения) Al способствуют ионы-депассиваторы, находящиеся в воде, повышающие скорость движения жидкости по отношению к поверхности металла. В связи с этим выход Al по току может достигать 130-140% Электрохимическое растворение Al в воде (анодное растворение)
На Al катоде могут протекать реакции (в природной воде)
Восстановление органических соединений
Из перечисленных катодных процессов в природной воде имеет место в основном кислородная и водородная деполяризация. На Al катоде возможно прохождение реакции Al с водой.
В прикатодном слое повышается рН до 10,5-12 во время электролиза, что приводит к растворению окисной пленки Al2O3. В процессе электролиза на электродах возможны следующие явления: 1. Адсорбция органических и неорганических веществ, которые способны повышать или понижать скорость электрохимической реакции. 2. Выделение пузырьков газа H2, O2 способных переносить вещество из жидкости на поверхность – электрофлотация. На процесс растворения электродов влияют: 1. рН 2. солевой состав 3. t 4. состав электрода 5. плотность тока 6. частота смены полярностей 7. скорость движения воды в межэлектродном пространстве.
Зависимость работы электролизера от плотности тока имеет следующий характер: - повышение плотности тока приводит к повышению эффективности работы в связи с повышением рабочей поверхности электродов; - интенсивно используется объем электролизеров. Дальнейшее повышение плотности приводит к усилению поляризационных явлений и пассивации электродов,в результате чего растет напряжение и электроэнергия затрачивается на побочные процессы. Рекомендуемая плотность тока 0,5-20 мА/ Для предотвращения образования осадка на электродах рекомендуется менять их полярность, но это приводит к снижению выхода металла по току. Процесс активного окисления металла при электролизе осложняется пассивацией поверхности электрода. Для Al электрода:
Рост температуры приводит к растворению окисной пленки, активизации электрода, растворимости осадка на электроде.
1. Реагентное хозяйство В состав реагентного хозяйства входят а) склады для хранения реагентов в сухом виде или в виде концентрированных растворов б) и устройства для приготовления растворов необходимой концентрации
Для приготовления раствора коагулянта используют специальные установки, состоящие из растворных и расходных баков, а также воздуходувок для перемешивания раствора реагентов (барботаж), механическое перемешивание. Вместимость растворных баков определяют
Р=17% для неочищенного коагулянта.
Емкость расходных баков
Раствор коагулянта пропускают самотеком из растворных баков в расходные и разбавляют водой до соответствующей концентрации. Расходных баков должно быть не менее двух, растворных в зависимости от скорости растворения коагулянта, способа доставки и загрузки К. Растворные и расходные баки изготавливают из ж/б, а их внутренние стенки обкладывают кислотоупорным кирпичом или кислотоустойчивой плиткой.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 556; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.009 с.) |


 - валентность металла;
- валентность металла;  - время, час;
- время, час;  - атомная масса металла;
- атомная масса металла; 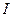 - сила тока, А;
- сила тока, А;  - число Фарадея (96500 кулон);
- число Фарадея (96500 кулон);  - коэффициент выхода металла по току, %.
- коэффициент выхода металла по току, %.
 - деполяризация мигрирующих ионов
- деполяризация мигрирующих ионов - в нейтральной среде деполяризация нейтральными молекулами
- в нейтральной среде деполяризация нейтральными молекулами - в кислой среде
- в кислой среде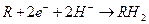
 - радикал органического соединения
- радикал органического соединения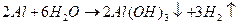

 расстояние между электродами 10-15 мм. Рабочее напряжение на электродах
расстояние между электродами 10-15 мм. Рабочее напряжение на электродах 
 - активизирует Al электрод.
- активизирует Al электрод. - пассивирует Al электрод
- пассивирует Al электрод
 =20-24%
=20-24% - часовой расход воды,
- часовой расход воды, 
 - доза коагулянта
- доза коагулянта - плотность коагулянта; t – время, необходимое для приготовления раствора коагулянта
- плотность коагулянта; t – время, необходимое для приготовления раствора коагулянта
 =10-12%
=10-12% - концентрация раствора коагулянта в расходных баках.
- концентрация раствора коагулянта в расходных баках.


