
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реагенты, используемые в технологии улучшения качества воды.Содержание книги
Поиск на нашем сайте
1.1 Неорганические коагулянты. К неорганическим коагулянтам относят сульфат и основной сульфат алюминия, гидроксихлорид алюминия, алюминат натрия, сульфат и хлорид железа. Коагулянты на основе алюминия. Высококонцентрированный сульфат алюминия в гранулированном виде, полученный автоклавным методом, содержит от 18 до 21 % товарного продукта в пересчете на окись алюминия. Автоклавный метод позволяет получать основной сульфат алюминия. Гидроксихлорид алюминия - высокоэффективный коагулянт нового поколения, в зависимости от свойств воды возможны поставки продукта различной основности, в жидком или твердом виде, разной концентрации. ГОХА по сравнению с сульфатом алюминия имеет следующие преимущества: эффекетивнее снижает мутность, способствует образованию более крупных хлопьев, работает в любое время года, обеспечивает снижение остаточного алюминия в обработанной воде в 3 раза, сохраняет больший щелочной резерв воды, увеличивает срок службы котлов без очистки, эффективнее осаждает тяжелые металлы и ртуть, снижает скорость коррозии в системах водоснабжения. Коагулянты на основе железа. Коагулянты на основе железа дают лучшие результаты при удалении из природных вод органических веществ, дающих побочные продукты дезинфекции прихлорировании. На сегодняшний день имеются коагулянты на основе железа не содержащие в своем составе ионов двухвалентного железа и марганца, что позволяет устранить стадию окисления и удаления их при коагуляционной обработке воды солями железа. Коагулянт на основе железа - РIХ - 322 N 5. Коагулянт на основе соединений титана. Использование титанового коагулянта позволяет очистить природную воду на ранней стадии от органических примесей, присутствующих в воде (нефтепродукты и их производные). Степень адсорбции органических соединений убывает в ряду: алканы, фталаты, ароматические углеводороды, циклогексаны, органические спирты. Физико-химические основы коагулирования примесей. Самостоятельно. Природные поверхностные воды представляют собой коллоидные растворы, размеры частиц в которых приближаются к размерам молекул и имеют как правило отрицательный заряд. Коллоидные растворы характеризуются агрегативной устойчивостью и процесс их очистки является сложной задачей. Для укрупнения мелкодисперсных частиц, увеличения скорости их осаждения и способности задерживаться пористыми фильтрами применяют коагуляцию. Коагуляция - это процесс разрушения коллоидных частиц под действием электролита, электрического или магнитного полей, сопровождающийся укрупнением диспергированных частиц и сорбцией их на поверхности гидратированного электролита. Коагуляция завершается образованием хлопьев, видимых невооруженным глазом, и отделением их от жидкой среды. Различают два типа коагуляции: конвективная коагуляция(проходящая в свободном объеме) и контактная (в толще зернистой загрузки или в массе взвешенного осадка). 2. Строение коллоидной частицы. NaCl+AgNO3(изб)=AgCl+NaNO3
Заряд частицы положительный, AgCl адсорбирует только те ионы, которые образуют кристаллическую решетку и находятся в избытке.
Ag + – потенциал- образующие ионы NO3 - – противоионы адсорбционного и диффузионного слоев Заряженные частицы препятствуют росту кристаллов Противоионы диффузионного слоя ориентируют полярные молекулы решетки, создавая дополнительную сольватную оболочку.
ƺ – потенциал на границе адсорбционного диффузионного слоев
Коллоидная частица всегда заряжена, м ицелла - электронейтральна
NaCl(изб)+AgNO3=AgCl
Разрушение коллоидной частицы называется коагуляцией. Переход осадка в золь называется пептизацией При нагревании или замораживании, добавлении в воду электролита, воздействии электрического или магнитного полей происходит разрушение двойного электрического поля и нарушение агрегативной устойчивости частицы. Природная вода содержит гидрофильные и гидрофобные примеси. Гидрофильные примеси представлены в основном органическими веществами,содержащими в своем составе полярные группы (-ОН, -СООН). Эти группы гидратированы и поэтому агрегативно устойчивы. Обработка воды, содержащей органические вещества в растворенном или коллоидном состоянии электролитами приводит к нарушению агрегативной устойчивости раствора. Гидрофобные примеси в воде представлены частичками глины, песка, породы. Они лишены гидратных оболочек, но имеют двойной электрический слой, характерный для коллоидных частиц. На границе адсорбционного слоя термодинамический потенциал ( Величина рН, отвечающая этому состоянию( Для отрицательно заряженных частиц коагулирующими ионами являются катионы, а для положительно заряженных - анионы. Коагуляция коллоидных растворов, имеющих противоположно заряженные частицы, возможна при их взаимном перемешивании, т.к в этом случае происходит взаимная нейтрализация разноименно заряженных частиц, их агломерация и седиментация. Действие коагулянта в воде сопровождается следующими процессами: - гидролиз электролита, -разрушение коллоидной частицы, -сорбция загрязняющих веществ на поверхности гидролизованного электролита, -соосаждение хлопьев. Гидроксиды алюминия и железа имеют положительный заряд на грануле, что способствует сорбции отрицательно заряженных примесей воды.
Чем больше ионная сила раствора, тем меньше КОАГУЛЯНТЫ И ИХ ГИДРОЛИЗ
СОЛИ АЛЮМИНИЯ Наибольшее применение в качестве коагулянта получил сульфат алюминия, который получают путем обработки сырой или обожженной глины серной кислотой с последующей фильтрацией раствора, упаркой и кристаллизацией. В качестве коагулянтов используются также алюминат натрия и оксихлориды алюминия. Исходными продуктами для получения алюмината натрия и оксихлорида алюминия служат свежеосажденная гидроокись или окись алюминия. Первый коагулянт получают растворением этих продуктов в разбавленном гидроксиде натрия, второй - в разбавленной соляной кислоте. Иногда для получения оксихлорида алюминия используют хлористый алюминий, являющийся отходом алюминиевой промышленности.
СОЛИ ЖЕЛЕЗА Наиболее распространенным коагулянтом является хлорное железо FeCl2, которое может быть получено обработкой железного лома хлором или методом анодного растворения железа в растворах поваренной соли. Железный купорос Fe SO4 получают из растворов, образующихся при травлении металла или методом анодного растворения железа в растворе серной кислоты. Применение аэрации дает возможность получать соли железа вида Недостатком железного купороса является необходимость иметь для перевода двухвалентного железа в трехвалентное высокий щелочной резерв (рН = 9) или применять дополнительное хлорирование его растворов.
СОСТАВ ПРОДУКТОВ ГИДРОЛИЗА.
Al2(SO4)3+6H2O= 6Al2(OH)
По условиям равновесия:
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 877; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.01 с.) |


 - поверхностный потенциал, возникает на границе твердой и жидкой фаз.
- поверхностный потенциал, возникает на границе твердой и жидкой фаз. +NaNO3
+NaNO3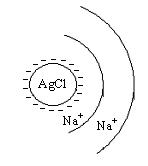 Заряд частицы отрицательный
Заряд частицы отрицательный ). При воздействии на коллоидную систему электрокинетический потенциал уменьшается и, при нулевом его значении наступает изоэлектрическое состояние коллоидной системы, коллоидный раствор разрушается.
). При воздействии на коллоидную систему электрокинетический потенциал уменьшается и, при нулевом его значении наступает изоэлектрическое состояние коллоидной системы, коллоидный раствор разрушается.

 система приближается к изоэлектрическому состоянию, что в свою очередь приводит к активной коагуляции.
система приближается к изоэлектрическому состоянию, что в свою очередь приводит к активной коагуляции. обладающие сильным коагулирующим действием.
обладающие сильным коагулирующим действием. +6H+ ; рН
+6H+ ; рН 



