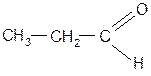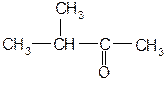Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Властивості фенолів, та їх похідних.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Дослід 1. Розчинність фенолу у воді. Помістити у пробірку 2-3 крупинки фенолу (Обережно!). Фенол викликає опіки шкіри. Додати 3 краплі води і струсити. Утвориться каламутна рідина (емульсія фенолу). Дати їй постояти. Звернути увагу, що при стоянні емульсія розшаровується: внизу буде розчин води в фенолі, вгорі-розчин фенолу у воді (фенольна або карболова вода). Даний розчин випробувати індикатором і зберегти для другого досліду. 1. Чи добре розчиняється фенол у воді? 2. Чи діє розчин фенолу на індикатор?
Дослід 2. Кислотний характер фенолу. До фенольної води, одержаної у попередньому досліді, додати ще 1 краплю фенолу. До утвореної емульсії фенолу у воді додати 2 краплі розчину натрій гідроксиду. Розчин зберегти для третього досліду. 1. Що при цьому спостерігається? 2. Написати рівняння реакції утворення феноляту.
Дослід 3. Розклад натрій феноляту кислотою. До одержаного у попередньому досліді натрій феноляту додати 1-2 краплі 2н розчину хлоридної кислоти. 1. Що спостерігається? 2. Написати рівняння реакції.
Дослід 4. Осадження білка фенолом. Помістити на предметне скло 2-3 краплі рідкого фенолу і 1-2 краплі розчину яєчного білка. Що спостерігається? Зробити висновок.
Дослід 5. Реакція фенолів з розчином ферум (ІІІ) хлоридом. У пробірку налити 3 краплі розчину фенолу і додати 1 краплю 0,1н розчину FeCl3. Що спостерігається? Проробити аналогічно реакції з 1% розчинами гідрохінону, пірокатехіну, резорцину, пірогалолу, α-нафтолу і β-нафтолу. Звернути увагу, що феноли можна ідентифікувати за цією реакцією. Дані досліду оформити у вигляді таблиці.
Дослід 6. Реакція фенолу з бромною водою (фармпроба). У пробірку помістити три краплі бромної води і додати дві краплі розчину фенолу. 1. Що спостерігається? 2. Написати рівняння реакції.
Дослід 7. Реакції фенолів з реактивом Марки. Кристалик резорцину помістити на годинникове скло і змочити його 1-2 краплями реактиву Марки (СН2О+Н2SO4(конц.)). Добуту суміш залишити на 5 хв. 1. Що спостерігається? 2. Яке забарвлення розчину утворилось?
Дослід 8. Відновні властивості багатоатомних фенолів. Взяти три пробірки, в першу з них налити 5 крапель розчину пірокатехіну, у другу-стільки ж розчину резорцину, в третю-гідрохінону. У кожну пробірку додати по 1-2 краплі розчину аргентум нітрату. 1. В яких пробірках спостерігаються зміни? 2. Які із зазначених фенолів можуть бути використані як фотопроявники? 3. Написати рівняння реакцій оксидації гідрохінону.
Дослід 9. Кольорова індофенолова проба. Налити у пробірку 2-3 краплі розчину фенолу, додати 3 краплі 2н розчину амоній гідроксиду і 3 краплі бромної води. Через кілька хвилин у пробірці спостерігається поява синього забарвлення, яке пов'язане з утворенням індофенолу. ЛІТЕРАТУРА Основна: 1. Черних В.П., Зименковський Б.С., Гриценко І.С. Органічна хімія в 3-х кн.- Харків, 1993. 2. Н.А. Тюкавкина, Ю.И. Бауков. Биоорганическая химия. – Москва, -"Медицина", 1991. 3. Посібник до лабораторних та семінарських занять з оргнічної хімії. – Харків, 1991. 4. Українська Державна Фармакопея. К., 2001. 5. Ахметов Н.С. Общая неорганическая химия; Учебное пособие для студентов хим.-тех. Спец. Вузов.,М.: Высш. шк., 1988г. 6. Крешков А.П. Основы аналитической химии. Т.1. Качественный анализ. М.: Высшая школа, 1986 г. 7. Алексеев В.Н. Курс качественного химического полумикроанализа, М., 1973 г. 8. В.І. Кабачний, Л.К. Осіненко, А.Д. Грицак та ін. Фізична і колоїдна хімія, -Х., 1999р. Додаткова: 1. А.В. Домбровський, В.М. Найдан. Органічна хімія.- К.: Вища школа, 1992. 2. О.В. Стеценко, Р.П. Виноградова. Біоорганічна хімія. Навчальний посібник.-К.: Вища школа, 1992. 3. Б.Н. Степаненко. Курс органической химии.-К., 1989. 4. В.М. Найдан. Органічна хімія. Малий лабораторний практикум.-К., 1994. 5. М.Н. Стромберг. Курс физической химии.-М.: Высшю шк, 1993. 6. Пономарьов В.Д. Аналитическая химия. Ч.1. Качественный анализ.-М.,1982 г. 7. Тагер В.М. Физикохимия полимеров. – М., 1980.
Методичні вказівки для студентів до практичних занять. ЗАНЯТТЯ №15 Тема: Альдегіди і кетони аліфатичного ряду. Актуальність теми: Альдегіди та кетони є карбонільними органічними сполуками, які по-різному відносяться до реакцій оксидації. Багато органічних сполук містять альдегідну або кетонну групи в тому числі і лікарські препарати. Тому знання даної теми необхідні для їх одержання та ідентифікації.
Навчальні цілі: Теоретичне і практичне засвоєння будови, властивостей, одержання та застосування альдегідів і кетонів. Малий практикум. Знати: - спільні властивості альдегідів і кетонів; - відмінні властивості альдегідів і кетонів; - реакції їх ідентифікації; - лікарські засоби даного класу органічних сполук.
Вміти: - писати гомологічні ряди альдегідів і кетонів; - давати назви згідно правил ІЮПАК; - писати формули ізомерів альдегідів і кетонів.
Самостійна позааудиторна робота 1. Вивчити теоретичний матеріал і вміти дати відповіді на контрольні питання теми.. 2. Написати формули ізомерів валерянового альдегіду. Дати їм назви. 3. Оформити три перші графи протоколу. 8. Написати рівняння реакцій добування ацетальдегіду всіма відомими способами. 9. Написати структурні формули всіх ізомерних карбонільних сполук аліфатичного ряду за формулою С6Н12О і назвати їх. 10. Скласти схему синтезу коричного альдегіду із ацетилену і толуолу. Контрольні питання 1. Електронна будова карбонільної групи та вплив на неї різних факторів. 2. Реакційні центри в молекулах альдегідів та кетонів. 3. Будова і класифікація карбонільних сполук. 4. Ізомерія і номенклатура альдегідів та кетонів. 5. Хімічні властивості альдегідів і кетонів. 6. Реакції оксидації та відновлення. 7. Реакції нуклеофільного приєднання, їх механізм. 8. Реакції ідентифікації альдегідів і кетонів. 9. α-, β-ненасичені дикетони, їх властивості та одержання. 10. Характеристика окремих представників альдегідів і кетонів та їх похідних, які використовуються як медичні препарати. Самостійна аудиторна робота
1. Виконати лабораторні досліди, передбачені методичною вказівкою.. 2. Результати спостережень і висновки внести в протокол 3. Оформити протокол і захистити його у викладача. 4. Написати тестовий контроль або індивідуальне самостійне завдання. 5. З навчального підручника виписати медичні препарати по даній темі та препарати аналогічної дії з УФД – 2001. 6. Дати назви слідуючим сполукам:
Теоретична частина
Альдегідами та кетонами називають похідні вуглеводнів, які містять у своєму складі спільну карбонільну групу, тому їх відносять до карбонільних сполук. В залежності від будови вуглеводневого радикала альдегіди і кетони поділяють на: а) аліфатинчі; б) аліциклічні; в) ароматичні. Серед аліфатичних альдегідів та кетонів розрізняють насичені та ненасичені. В номенклатурі альдегідів та кетонів вживають тривіальні та систематичні назви. Тривіальні назви альдегідів походять від назв кислот, які утворюються при їх окисненні. За замісниковою номенклатурою ІЮПАК назви альдегідів утворюють від назви вуглеводню з тим самим числом атомів у головному ланцюзі (включаючи вуглець альдегідної групи) з додаванням суфікса –аль. Для кетонів широко застосовують радикало – функціональну номенклатуру, згідно з якою до назв в алфавітному порядку вуглеводневих радикалів при карбонільній групі добавляють суфікс –кетон. При утворенні назв за замісниковою номенклатурою обирається найдовший вуглецевий ланцюг, до складу якого входить кетогрупа. Нумерацію проводять таким чином, щоб атом карбону карбонільної групи отримав якомога менший номер. Потім до назви насиченого вуглеводню, що містить ту саму кількість атомів карбону додають суфікс-он і цифрою позначають атом карбону, який входить до кетогрупи. Для карбонільних сполук характерна структурна ізомерія. Альдегіди і кетони, які містять однакову кількість атомів карбону ізомерні між собою. Ізомерія альдегідів і кетонів пов’язана з різною структурою вуглецевого ланцюга. Для кетонів є характерною також ізомерія, зумовлена положенням карбонільної групи. Альдегіди та кетони одержують шляхом: а) окисненням спиртів; б) гідратацією алкінів (реакція Кучерова); в) гідролізом гемінальних дигалогеналканів; г) піролізом солей карбонових кислот; д) озонолізом алкенів; е) оксосинтезом. Реакційна здатність карбонільних сполук визначається величиною позитивного заряду на атомі вуглецю СО-групи. Альдегіди як правило більш реакційно здатні, ніж кетони. Наявність у молекулі кетону двох алкільних груп при карбонільному угрупованні приводить до більшого зниження позитивного заряду, ніж у молекулі альдегіду. Всі реакції альдегідів та кетонів можна поділити на такі групи: а) нуклеофільне приєднання (приєднання синильної кислоти, натрій гідросульфіту, води, спиртів); б) приєднання-відщеплення (взаємодія з аміаком, амінами, гідроксиламіном, гідразином та ін.); в) конденсації (альдольна, кротонова, складноефірна); г) за участю α-вуглецевого атома; д) полімеризації (ди-, три-, тетрамеризації); е) окиснення та відновлення (реакції срібного і мідного дзеркала). Ненасичені альдегіди проявляють як властивості ненасичених так і ароматичних сполук. Ідентифікують альдегіди та кетони як хімічними та фізичними методами. Медичні препарати: формалін, хлоральгідрат, уротропін, цитраль ванілін та ін. Практична робота
|
||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 526; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.217.176 (0.007 с.) |