
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізичні та хімічні методи дослідження (ідентифікації) органічних речовинСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Дослід 1. Визначення температури плавлення.
Прилад для визначення температури плавлення. Для визначення температури плавлення, досліджуваною речовиною наповнити (0,5 см. висотою) капіляр, один кінець якого запаяний. Потім капіляр із речовиною прикріпити до кінця термометра, так, щоб стовпчик речовини містився на рівні кульки термометра. Прилад нагріти на газовому пальнику або спиртівці і зазначити температуру плавлення. Після визначення приблизної температури, прискорити нагрівання. Коли речовина повністю розплавиться, відмітити температуру кінця плавлення. Різниця початку і кінця температури плавлення буде точною температурою.
Дослід 2. Визначення температури кипіння. В широкий капіляр налити кілька крапель досліджуваної рідкої речовини і прикріпити його до кінця термометра гумовим кільцем. Нагріти. Коли бульбашки будуть швидко виділятися, це означає, що рідина закипіла. Нагрівання припинити, дати остигнути і зазначити температуру при якій пухирці перестали виділятися. Ця температура і є температурою кипіння досліджуваної рідини.
Дослід 3. Відношення органічної речовини до прожарювання. На кінчик шпателя нанести 0,1 г досліджуваної речовини і внести його в бокову частину полум'я пальника. Уважно спостерігати за змінами: а) характером плавлення (чи розкладається, горить повільно, дуже швидко, зі спалахом); б) коліром полум'я (світле свідчить, що речовина кисневмісна, жовто-кіптяве – ароматична, сильно ненасичена сполука з високим вмістом Карбону); в) запах (різкий, приємний, неприємний).
Дослід 4. Визначення розчинності органічних речовин Перевірити розчинність досліджуваних речовин послідовно у: воді, 5%-ному розчині натрій гідроксиді, натрій гідрокарбонаті, хлоридній кислоті, концентрованій сульфатній кислоті, етанолі, бензолі, петролейному етері та ацетатній кислоті. Розчинення проводити при звичайних умовах, а коли речовина не розчиняється, нагріти її до кипіння. Якщо речовина погано розчиняється в розчинах лугу, натрій гідрокарбонаті і хлоридній кислоті, то нерозчинний залишок відфільтрувати. Якщо фільтрат мутніє, то це свідчить про кислотно-основні властивості речовини; кислі – коли розчинником був розчин лугу або соди, основні – розчин кислоти. Визначити рН розчину за допомогою індикатора або приладу рН-метра.
Дослід 5. Функціональний аналіз органічних сполук. а) реакція на альдегіди "срібного дзеркала". В добре очищену і знежирену пробірку налити 3-5 крапель розчину аргентум нітрату і по краплях прилити розчину аміаку до зникнення осаду. По стінках пробірки прилити досліджуваного розчину. Вміст пробірки нагріти на киплячій водяній бані, уникаючи струшування.
(). Написати рівняння оксидації альдегіду до відповідної кислоти. б) реакція "мідного дзеркала". До 5 крапель розчину купрум (ІІ) сульфату прилити 5 крапель розчину натрій гідроксиду, а потім до одержаного осаду прилити 5-7 крапель розчину досліджуваної речовини. Вміст пробірки нагріти як в попередньому досліді. Якщо забарвлення змінюється від голубого до жовтого, а в кінці морквяно червоного то досліджувана речовина є альдегідом. Написати рівняння реакції послідовного відновлення альдегідом: Cu(OH)2 → CuOH→ Cu2O/ Дана реакція використовується в біохімічних дослідженнях для виявлення надлишку глюкози в сечі. Дослід 6. Якісна реакція на фенольний гідроксид. а) До 3-5 крапель досліджуваного розчину прилити 1-2 краплі розчину ферум (ІІІ) хлориду. Якщо появиться фіолетове забарвлення значить речовина є фенолом.
б) Проробити аналогічну реакцію з розчином саліцилової кислоти, а потім долити в обидві пробірки етанолу. Чи змінилось забарвлення у водному і спиртовому розчинах? Зробити висновок. Дослід 7. Ознайомлення з будовою та принципом дії поляриметра Для роботи з поляриметром необхідно спочатку встановити нульову його точку. Для цього слід повертати важелем аналізатора і домогтися рівномірного освітлення поля зору в окулярі:
Поле зору поляриметра 1,3 - поляризоване світло не проходить через аналізатор; 2 - поляризоване світло проходить через аналізатор.
Для визначення нульової точки і дослідження оптичної активності речовини, роблять 4-5 відліків, а потім обчислюють середнє значення. Нульову точку встановлюють за дистильованою водою, яку наливають в трубку поляриметра по верхньому меніску. На меніск води ставлять скельце, щоб не утворилося пухирців повітря, добиваючись чіткого зображення поля зору поляриметра. Якщо аналізатор повертати вправо (за годинниковою стрілкою), то ставлять знак "+", якщо вліво – знак "-". Тоді речовини відповідно називають право-, або лівообертаючими. Для визначення кута обертання оптично-активної речовини аналізатор промивають досліджуваним розчином 2-3 рази, наливають свіжоприготовлений розчин і проводять визначення аналогічно, як і з дистильованою водою, за шкалою визначають величину кута. Питоме обертання визначають за формулою:
де a - знайдений кут обертання; с – маса оптично активної речовини в грамах на 100 мл розчину;
Дослідження повторити два три рази. Величину кута визначити як середнє арифметичне. Одержаний результат звірити з табличними даними за хімічним довідником. Дане дослідження широко використовується в аптечній справі для визначення концентрації рідких лікарських форм. ЛІТЕРАТУРА Основна: 1. Черних В.П., Зименковський Б.С., Гриценко І.С. Органічна хімія в 3-х кн.- Харків, 1993. 2. Н.А. Тюкавкина, Ю.И. Бауков. Биоорганическая химия. – Москва, -"Медицина", 1991. 3. Посібник до лабораторних та семінарських занять з органічної хімії. – Харків, 1991. 4. Українська Державна Фармакопея. К., 2001. 5. Ахметов Н.С. Общая неорганическая химия; Учебное пособие для студентов хим.-тех. спец. Вузов., М.: Высш. шк., 1988г. Додаткова: 1. А.В. Домбровський, В.М. Найдан. Органічна хімія.- К.: Вища школа, 1992. 2. О.В. Стеценко, Р.П. Виноградова. Біоорганічна хімія. Навчальний посібник.-К.: Вища школа, 1992. 3. Б.Н. Степаненко. Курс органической химии.-К., 1989. 4. В.М. Найдан. Органічна хімія. Малий лабораторний практикум.-К., 1994. Методичні вказівки для студентів до практичних занять. ЗАНЯТТЯ №5
|
||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 475; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.224 (0.006 с.) |



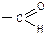 Якщо розчин буріє і на стінках пробірки виділяється чистий аргентум; значить досліджувана речовина містить функціональну альдегідну групу
Якщо розчин буріє і на стінках пробірки виділяється чистий аргентум; значить досліджувана речовина містить функціональну альдегідну групу

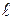 - товщина шару розчину.
- товщина шару розчину.


