Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Оптимизация экспрессии клонированных геновСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Увеличение числа копий рекДНК в клетках Для повышения экспрессии используется повышения числа копий рекомбинантного гена в клетке. Использование мультикопийных векторов – т.е. векторов, которые реплицируются в клетке независимо от хозяйской ДНК, позволяет эффективно амплифицировать рекДНК в клетке-хозяине. Однако есть опасность возникновения состояния метаболической перегрузки в клетках, непосредственного токсического действия рекомбинантного белка. В этих условиях при экспрессии рекомбинантного белка может возникать частота трансляционных ошибок. Это может иметь нежелательные последствия при использовании рекомбинантного продукта, например, в случае использования фермента в качестве лекарственного препарата при введении в организм человека может возникать иммунная реакция.
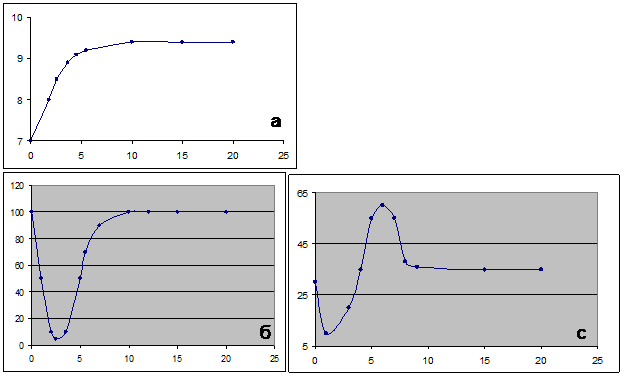
Рис.5.1.1. Изменение во времени числа клеток (а) и числа копий различных плазмид в клетках E.coli (б, с)
Использование экспрессионных векторов Для обеспечения эффективной экспрессии клонированного фермента используется ряд приемов. Одним из них служит использование специальных экспрессионных векторов. Такие векторы содержат необходимые последовательности промоторов, терминаторов для эффективной транскрипции. Кроме того, сконструированы и используются специальные трансляционные экспрессионные векторы, включающие последовательность Шайна-Дальгарно для эффективного связывания мРНК с рибосомами. Использование сильных, контролируемых промоторов
Экспрессионные векторы содержат сильные промоторы, под контроль которых попадает клонированный фрагмент. Такой промотор имеет высокое сродство к РНК-полимеразе. Непрерывная экспрессия чужеродного гена может оказаться губительной для клетки-хозяина, поскольку происходит истощение ресурсов клетки. Поэтому необходимо, чтобы сильный промотор был контролируемым. Кроме того важно, чтобы ген экспрессировался в определенную фазу клеточного цикла. Например, промотор может контролироваться температуро-чувствительным репрессором. В этом случае при температуре 28-30оС такой регулятор блокирует транскрипцию с промотора. Когда культура достигает нужной фазы (обычно середины логарифмической фазы роста) температуру повышают до 42оС, при которой репрессор инактивируется и начинается экспрессия. Экспрессионные системы должны включать, соответственно, и ген репрессора, который часто помещается в другой вектор.
Рефолдинг выделенного белка Иногда биосинтез целевого белка происходит настолько быстро и его концентрации настолько высоки, что белок может агрегировать, образуя так называемые тельца включения. Для преодоления этого явления может быть использован рефолдинг выделенного белка. Создание химерных белков Низкий уровень экспрессии чужеродного белка может быть обусловлен деградацией в хозяйских клетках. Один из способов стабилизации чужеродных белков – это присоединение к какому-либо белку клетки-хозяина. Такие соединенные белки носят название химерных. Слияние белков осуществляется на уровне слияния кодирующих последовательностей. При этом важно не нарушить рамку считывания. В зависимости от назначения белка он может быть использован в составе химерного белка (что встречается нечасто), либо требуется отщепление хозяйского белка. Один из способов – соединение белков с помощью специальной последовательности, которая распознается определенной протеазой. Это программируется на уровне нуклеотидной последовательности. Пример такого олигонуклеотидного линкера – последовательность, кодирующая полипептид Ile-Glu-Gly-Arg. После синтеза и очистки можно использовать для расщепления фактор свертывания крови Xa. Эта протеиназа специфична в отношении указанной последовательности. Поскольку такой пептид редко встречается в природных белках, его можно использовать для многих химерных рекомбинантных ферментных продуктов. Химерные белки могут быть также использованы для упрощения процедуры очистки. Определенный полипептид в составе белка (маркерный полипептид) может использоваться для очистки с помощью иммуно-аффинной хроматографии. Для этого моноклональные антитела к маркерному полипептиду фиксируются на носителе (колонке) через которую пропускают химерный белок. Химерные белки могут создаваться с целью повышения растворимости. Так, при соединении рекомбинантного белка с белком E.coli тиоредоксином повышает растворимость белка.
Повышение числа копий гена в плазмиде Повышения числа копий плазмиды в клетках не всегда эффективно, т.к. чрезмерная амплификация плазмидных ДНК может нарушать рост клеточной культуры. Поэтому может использоваться встраивание нескольких копий гена в малокопийную плазмиду. Для этого конструируют набор тандемных копий гена. Стабилизация белков путем присоединения концевых аминокислот Присоединение определенных концевых аминокислот (присоединением кодирующего их фрагмента к гену) может повысить время жизни рекомбинантных белков от нескольких минут до нескольких часов. Повышение эффективности секреции Многие белки оказываются значительно стабильнее, если они секретируются в периплазму, а не остаются в цитоплазме. Такие белки также легче выделить и очистить. Обычно транспорт через мембрану обеспечивает N-концевая сигнальная последовательность. Вводя этот сигнальный пептид в белок, удается повысить эффективность секреции. Увеличение стабильности рекДНК в клетках Плазмидные векторы могут утрачиваться после ряда клеточных циклов и не содержащие плазмиды клетки могут получить преимущество в росте. Нестабильность плазмид является серьезной проблемой, которую необходимо решать при промышленном использовании рекомбинантных систем. Повышение стабильности может быть связано с постоянным использованием селективных питательных сред, а не только на первоначальном этапе при клонировании.
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 798; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.126.79 (0.013 с.) |