
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 5. Прикладное значение ферментовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
РАЗДЕЛ 5. ПРИКЛАДНОЕ ЗНАЧЕНИЕ ФЕРМЕНТОВ ЛЕКЦИЯ 5.1. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ ФЕРМЕНТОВ
Генетическая инженерия ферментов представляет собой искусственное создание ферментов с использованием методов генной инженерии: технологий рекомбинантных ДНК или молекулярного клонирования. С помощью генетической инженерии могут создаваться: · ферменты, называемые рекомбинантными ферментами (аналогичные природным либо модифицированные); · клетки, экспрессирующие ферменты, – рекомбинантные клетки (фермент может быть необходим не в изолированном виде, а в виде экспрессирующих его клеток);
Технологии рекомбинантных ДНК Основу генной (или генетической) инженерии составляют технологии рекомбинантных ДНК. Рекомбинантные ДНК – это искусственно созданные молекулы ДНК, представляющие собой гены (фрагменты ДНК), встроенные в специальные молекулы ДНК (векторы), которые могут обеспечить увеличение копий гена, а также его экспрессию. Умножение гена происходит вместе с делящимися клетками ‒ клоном, несущим рекДНК, поэтому технологии рекомбинантных ДНК также называют молекулярным клонированием.
Основные этапы молекулярного клонирования Основными этапами молекулярного клонирования являются следующие процедуры:
Кроме перечисленных основных этапов могут присутствовать и дополнительные. Так ген, кодирующий фермент, может быть подвергнут модификациям, в частности, сайт-специфическим изменениям с целью изменения свойств фермента. В процессе создания экспрессионной системы могут быть использован ряд подходов для увеличения эффективности экспрессии – оптимизация экспрессии клонированных генов. Последний этап молекулярного клонирования зависит от его целей. Если конечным продуктом является сам фермент, то он выделяется из клеток и подвергаться очистке. Может также использоваться реакция, катализируемая ферментом в виде рекомбинантных клеток. В зависимости от того, какие клетки используются для молекулярного клонирования, выделяют прокариотические и эукариотические системы. Эти системы различаются используемыми векторами и регуляторными элементами. Прокариотические системы более просты. Поэтому, если применение клонирования в бактериальных клетках возможно, то предпочтительно используются они. Однако из-за специфических особенностей экспрессии синтеза эукариотических ферментов часто прокариотические системы использовать невозможно. В таких случаях необходимы эукариотические системы. На сегодняшний день генетическая инженерия представляет быстро развивающуюся область науки и технологий и ее рассмотрению может быть посвящен целый отдельный курс. Поэтому нижеприведенное описание этапов генно-инженерных манипуляций представляет собой только краткое их описание.
Получение гена, кодирующего фермент Необходимый ген, кодирующий фермент может быть получен несколькими способами: · химическим синтезом, · синтезом методом ПЦР (полимеразной цепной реакции), · выделением из геномной ДНК, · синтезом с мРНК. Синтезировать химическим путем удается относительно небольшие фрагменты ДНК, кодирующие небольшое число аминокислот. С разработкой и внедрением ПЦР этот метод стал все более активно использоваться и для синтеза генов. Получение гена из геномной ДНК производится с использованием сайт-специфических эндонуклеаз рестрикции, называемых рестриктазами. Эти ферменты сыграли огромную роль в развитии генной инженерии. Рестриктазы разрезают двойную спираль по специфическим последовательностям из 4-8 нуклеотидов. Они могут вносить тупой или ступенчатый разрез. Под действием рестриктаз, вызывающих ступенчатые разрывы, на обоих концах фрагмента ДНК образуются короткие одноцепочечные участки. Их называют “липкими концами”. Они способны к комплементарному взаимодействию с другим концом, образовавшимся под действием одного и того же фермента. Это используется для встраивания гена в вектор. Необходимо отметить, что способ получения гена из геномной ДНК, путем разрезания всей геномной ДНК с помощью рестриктаз приводит к тому, что клонируется огромное количество фрагментов. Это ведет к большому объему работы на этапе клонирования. Ген может быть получен с помощью синтеза фрагмента ДНК с матричной РНК с использованием обратной транскриптазы. Такие фрагменты называют кДНК (комплементарными ДНК). Этот способ обладает следующими преимуществами: фракция мРНК, выделяемая из клеток представляет собой копии только активных – экспрессирующихся генов, в то время как геномная ДНК содержит большой объем неэкспрессируемых последовательностей. Кроме того, кДНК лишены интронов. Это может быть очень актуальным при клонировании эукариотических генов в прокариотических системах.
Вставка гена в вектор Ген вводится в специальные молекулы ДНК, которые обеспечивают функционирование гена в новой генно-инженерной системе. Генетические элементы, используемые для создания рекомбинантной ДНК и введения ее в клетку, называют векторами. В качестве векторов чаще всего используют вирусы и плазмиды. Плазмидные векторы созданы на основе природных бактериальных плазмид. Они представляют собой небольшие кольцевые молекулы двухцепочечной ДНК. Такие векторы способны автономно реплицироваться благодаря наличию точки инициации репликации (ori). Плазмиды, которые используются в генной инженерии, содержат селективные маркеры. В качестве селективных маркеров часто используются гены устойчивости к антибиотикам. Обычно векторная молекула несет более одного селективного маркера. Благодаря таким маркерным генам на последующих этапах клетки, несущие рекомбинантную плазмиду, легко отделить от клеток, не имеющих такой рекДНК. Вставка гена в вектор, т.е. создание рекДНК осуществляется стандартно с использованием рестриктаз. Векторная молекула, кроме ori и селективных маркеров должна нести уникальные сайты рестрикции для нескольких рестриктаз. Уникальный сайт рестрикции обеспечивает то, что при обработке соответствующей рестриктазой кольцевая молекула будет разрезана в одном строго определенном месте и превратится в линейную. При соединении клонируемого гена и вектора, обработанных одной и той же рестриктазой, эти молекулы могут соединяться в одно целое путем спаривания оснований «липких концов». Полученная молекула ДНК (вектор со встроенным геном) называется рекомбинантной (рекДНК). Соответственно, кодируемые рекомбинантными ДНК ферменты называют рекомбинантными ферментами, а клетки, экспрессирующие такие ферменты (или другие белки) – рекомбинантными клетками или рекомбинантными системами.
Трансформация клеток рекомбинантными ДНК Рекомбинантные кольцевые молекулы ДНК вводят в клетки (обычно бактериальные или дрожжевые), то есть трансформируют плазмидами. Для этого их делают временно проницаемыми для ДНК. Для повышения проницаемости клеток их обрабатывают ионами Ca2+ на холоду или обрабатывают электрическим током (процедура носит название электропорации). Если используется рекДНК, созданная на основе вирусного вектора, то процедура введения рекДНК в клетки носит название трансфекции. После трансформации/трансфекции клеткам предоставляются оптимальные условия для размножения. Далее клетки высевают на плотную питательную среду для того, чтобы каждая клетка дала клон.
Отбор клонов Все клетки одного клона генетически однородны и могут быть нескольких вариантов: · не содержать рекДНК, · содержать вектор без вставки гена; · содержать рекДНК. Для того, чтобы выявить клоны, содержащие рекДНК используется отбор на основе селективных маркеров. Так, когда в качестве селективных маркеров используется гены устойчивости к антибиотикам, клетки высевают на селективную питательную среду, содержащую соответствующий антибиотик. В таком случае расти будут только те клетки, которые имеют вектор с геном устойчивости. Чтобы выявить клетки, несущие не просто вектор, а рекДНК, используется отбор на основании второго маркера. В случае клонирования фрагментов, полученных из геномной ДНК или кДНК получают набор клонов, несущих рекДНК с различными вставками – библиотеки геномной и кДНК. Для отбора клона с нужным геном из библиотеки используется гибридицация нуклеиновых кислот или анализ с помощью антител к белковому продукту клонированного гена.
Функционирование гена в клетке-реципиенте (адаптация гена) Плазмида, попадающая в клетку-хозяин и придающая ей новые свойства является нестабильным образованием. Возможна ее деструкция под действием нуклеаз. Кроме того, на ее стабильность оказывает влияние динамика роста всей клеточной популяции. Выявляются определенные кинетические закономерности репликации плазмид. Число плазмид на клетку не является постоянным, а закономерно изменяется в процессе роста популяции. При этом все наблюдаемые случаи могут быть разделены на два типа – монофазные и двухфазные процессы (рис.5.1.1). В первом случае клетки временно теряют некоторое количество плазмид. Второй случай более сложен: уменьшение числа плазмид на начальном этапе в последующем сопровождается их гиперпродукцией. Считается, что особенности кинетики репликации плазмид первого и второго типа обусловлены наличием периода индукции в случае плазмид второго типа.
ЛЕКЦИЯ 5.2 Энзимодиагностика
Ферменты сыворотки крови
Большинство ферментов находится во внутриклеточной среде (в цитоплазме и органеллах). Тем не менее, о скорости синтеза ферментов и об интенсивности выхода из клеток можно судить по их активности в биологических жидкостях (кровь, слюна, ликвор и др.). Наиболее важным в диагностическом процессе является исследование ферментов плазмы крови. Ферменты, которые обнаруживаются в норме в плазме или в сыворотке крови условно можно разделить на три группы: секреторные, индикаторные и экскреторные. Секреторные ферменты синтезируются в печени, в норме выделяются в плазму крови, где играют определённую физиологическую роль. Например, это ферменты, участвующие в процессе свёртывания крови. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определённые внутриклеточные функции (например, лактатдегидрогеназа, альдолаза и др.). Уровень их сывороточной активности зависит от содержания энзимов в тканях, молекулярной массы, внутриклеточной локализации, прочности связи фермента со своей органеллой, а также от скорости гидролитического разрушения и элиминации. Большая часть индикаторных ферментов в норме определяется в сыворотке крови лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь, их активность в сыворотке резко возрастает и таким образом, является индикатором степени и глубины повреждения этих тканей. Клеточные ферменты принято делить на неспецифические и органоспецифические (см. выше). Экскреторные ферменты образуются пищеварительными железами и из их секретов поступают в кровь. К ферментам этой группы можно отнести амилазу, липазу, трипсин и др. Существует другая классификация сывороточных ферментов, по которой их делят на функциональные и нефункциональные. Функциональные ферменты – те ферменты, которые в норме постоянно циркулируют в крови человека и выполняют физиологические функции. К ним относят, например, проферменты компонентов свёртывающей и противосвёртывающей систем крови. Эти ферменты синтезируются в печени, их концентрация в крови такая же, как в тканях, или более высокая. Нефункциональные ферменты плазмы известных физиологических функций в крови не выполняют, их субстраты в плазме не обнаруживаются. Активность нефункциональных ферментов в норме в крови очень мала. Например, это ферменты, выделяемые эндокринными железами: панкреатическая амилаза и липаза, щелочная фосфатаза (из желчи), кислая фосфатаза (из предстательной железы). Причинами появления нефункциональных ферментов в плазме крови являются нормальные процессы разрушения клеток (эритроцитов, лейкоцитов и др.) и удаление ферментов из внеклеточной жидкости путём инактивации и деградации или экскреции.
Во внеклеточной жидкости
Метаболизм ферментов складывается из их синтеза, функционирования и распада. Эти процессы идут непрерывно и одновременно и обеспечивают определённый уровень активности ферментов в тканях. Как было отмечено выше, активность нефункцональных ферментов плазмы крови в норме небольшая. Однако количество таких ферментов значительно увеличивается при повреждении мембран клеток, их усиленной пролиферации или гибели (рис. 5.2.1). Многие факторы способны повышать проницаемость мембран и таким образом вызывать появление внутриклеточных ферментов в плазме. К таким факторам относятся недостаток притока кислорода в клетку, снижение концентрации глюкозы в крови, присутствие многих лекарственных и химических веществ, блокирующих гликолиз, работу ЦТК и окислительное фосфорилирование. Патогенные бактерии, бактериальные токсины и вирусы воздействуют непосредственно на мембрану. Кроме того, существуют генетически обусловленные нарушения структуры мембран. Утечка ферментов, то есть выход внутриклеточных ферментов в кровь, может быть обратимой или прогрессировать до необратимой стадии. При выделении ферментов скорость их появления в крови зависит от трёх основных факторов. Прежде всего, от градиента концентрации, обеспечивающего движение ферментов через мембрану. Величина его различна для разных ферментов и типов тканей. Например, активность ЛДГ в клетках печени примерно в 3000 раз, в эритроцитах – в 200 раз выше, алкогольдегидрогеназы – в 20000, аспартат- и аланинаминотрансфераз – в 10000 раз выше, чем в плазме крови. Чем выше градиент, тем быстрее фермент появляется в крови. Второй фактор – размер молекул фермента. Более мелкие молекулы диффундируют с большей скоростью, чем крупные, и выделяются на ранней стадии повреждения мембраны. Третий фактор – внутриклеточная локализация ферментов. В первую очередь в плазму выходят цитоплазматические ферменты, а при некрозе клетки, когда разрушаются внутриклеточные органеллы, – и митохондриальные. Примером может служить увеличение в крови активности аспартатаминотрансферазы (АсАт). И цитоплазматическая, и митохондриальная форма фермента имеет одинаковую молекулярную массу, а митохондриальная выходит в кровь значительно медленнее.
Рис. 5.2.1. Факторы, влияющие на активность ферментов в плазме крови
Кроме этого, изменение активности ферментов в сыворотке крови может быть обусловлено присутствием во внеклеточной жидкости активаторов или ингибиторов ферментов, обструкцией (непроходимостью) путей секреции ферментов в полости, а также удалением ферментов из циркуляторного русла. О механизмах удаления ферментов из системы циркуляции известно мало. Большинство ферментов, по-видимому, катаболизируются плазменными протеазами и удаляется ретикулоэндотелиальной системой. Часть ферментов выделяется со слюной, желчью и другими секреторными жидкостями. Через почечный фильтр выводятся небольшие молекулы с Mr не более 60-70 кДа, поэтому в норме, количество экскретируемых ферментов невелико. Например, фермент амилаза имеет Mr = 48кДа и может выводиться почками. Нужно отметить, что наиболее важными, с диагностической точки зрения, являются те изменения, которые возникают в результате нарушения скорости образования специфических ферментов вследствие либо повышения их синтеза клетками, либо увеличения количества таких клеток. Имеет значение также увеличение количества ферментов в крови, связанное с выделением их из повреждённых или мёртвых клеток.
Ферментативной активности
Нужно отметить, что не всегда повышение активности фермента в сыворотке крови отражает тяжесть заболевания. Бывает так, что на наличие заболевания указывает не повышение, а наоборот, снижение ферментативной активности. Так, например, острое повреждение клеток при вирусном гепатите может сопровождаться очень высоким подъёмом активности ферментов, которая падает по мере выздоровления. В то же время, при циррозе печень может быть значительно сильнее вовлечена в патологический процесс, но активность ферментов в сыворотке будет либо незначительно повышена, либо находиться в пределах референтных величин, или же будет ниже нормы. Снижение активности ферментов при циррозе и при других тяжёлых заболеваниях печени может быть обусловлено тем, что при циррозе скорость повреждения клеток печени ниже, чем при других острых заболеваниях и, следовательно, снижается скорость выхода ферментов в сыворотку. Кроме этого, при циррозе имеет место глубокое нарушение способности печени синтезировать белки. Например, при циррозе печени в сыворотке крови резко снижается активность фермента холинэстеразы (ХЭ, ложная холинэстераза). Этот фермент синтезируется в печени, легко переходит в кровь и поэтому его активность в плазме высока. Но при некоторых тяжёлых заболеваниях печени активность ХЭ резко снижается. Это указывает на нарушение способности печени синтезировать белки и служит признаком тяжёлого цирроза. Таким образом, любые результаты по активности ферментов в сыворотке крови должны быть обязательно сопоставлены с другими лабораторными анализами и с клинической картиной заболевания.
Лактатдегидрогеназа
Лактатдегидрогеназа (ЛДГ, L-лактат: NAD-оксидоредуктаза; К.Ф. 1.1.1.27) – цитоплазматический, Zn-содержащий гликолитический фермент, обратимо катализирующий восстановление пировиноградной кислоты в молочную кислоту:
Фермент широко распространён в организме человека. По степени убыли активности ЛДГ органы и ткани можно расположить в следующей последовательности: почки, сердце, скелетные мышцы, поджелудочная железа, селезёнка, печень, лёгкие, сыворотка крови. ЛДГ содержится в значительном количестве в эритроцитах, поэтому исследуемая сыворотка не должна содержать следов гемолиза. ЛДГ имеет пять изоферментов, представляющих различные комбинации из четырёх субъединиц двух основных типов – Н (от англ. heart – сердце) и М (от англ. muscle – мышца): ЛДГ1 – 4Н; ЛДГ2 – 3Н1М; ЛДГ3 – 2Н2М; ЛДГ4 – 1Н3М; ЛДГ5 – 4М. Изоферменты ЛДГ нумеруются в соответствии с электрофоретической подвижностью по направлению к аноду (рис. 5.2.2). На рисунке показано распределение и относительное количество изоферментов ЛДГ в различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся к аноду, а один (ЛДГ5) к катоду.
Рис. 5.2.2 Распределение и относительное количество изоферментов ЛДГ в различных органах
Протекание прямой реакции превращения пирувата в лактат обеспечивает М субъединица ЛДГ, протекание обратной реакции – Н субъединица (рис. 5.2.3).
Рис. 5.2.3. Обратимая реакция превращения пирувата в лактат, катализируемая ЛДГ
Изоферментный спектр и тип обмена веществ в ткани коррелируют между собой. Так, в тканях с преимущественно аэробным обменом веществ (мозг, сердце, почки и др.) наибольшей активностью обладают ЛДГ1 и ЛДГ2, в тканях с выраженным анаэробным обменом веществ (печень, скелетная мускулатура и др.) преобладают ЛДГ4 и ЛДГ5. Наиболее высокое содержание ЛДГ3 отмечают в лимфоидной ткани, тромбоцитах и опухолях. Это распределение имеет большой биологический смысл. Изофермент ЛДГ1 in vitro активен при низкой концентрации пирувата и ингибируется его избытком, в то время как ЛДГ5 сохраняет активность при сравнительно высоких концентрациях пирувата. Поскольку восстановление пирувата в лактат, катализируемое ЛДГ1, сильно ингибируется уже небольшими концентрациями пирувата, то в ткани, богатой этим изоферментом, например в сердце, пируват подвергается преимущественно аэробному окислению. Кроме активной переработки собственного (эндогенного) лактата, сердечная мышца способна поглащать лактат из крови, затем превращать его в пировиноградную кислоту и подвергать дальнейшему окислению для пополнения запасов АТР. С другой стороны, в тканях, где преобладают изоферменты ЛДГ4 и ЛДГ5 (печень, скелетная мускулатура), АТР в значительной степени образуется за счёт гликолиза. Высокая активность ЛДГ5 в них обеспечивает быстрое превращение пирувата в лактат, который затем выбрасывается в кровь, поскольку в скелетной мускулатуре дальнейшее превращение лактата почти не осуществляется. Однако в некоторых тканях нет зависимости между типом обмена и изоферментным спектром. Так в эритроцитах, тромбоцитах, хрусталике глаза, где преобладает анаэробный обмен, фермент представлен в основном изоферментами ЛДГ1 ЛДГ2. Молекулярная масса каждой изоформы ЛДГ составляет 135 кДа (по другим данным 140 кДа), а каждой субъединицы – 34 кДа (по другим данным – 33,5 кДа). Вместо лактата ЛДГ может окислять α-гидроксибутират до α-оксибутирата. Особенно высокую активность в отношении α-гидроксибутирата по сравнению с лактатом проявляет ЛДГ1. Вследствие этого ЛДГ1 обычно измеряют с использованием именно этого субстрата, а данный изофермент (ЛДГ1) имеет второе название – α-гидроксибутиратдегидрогеназа (α-ГБДГ). Соотношение между изозимами ЛДГ, по данным разных авторов при электрофорезе на ацетатцеллюлозных плёнках составляет у взрослых:
Это соотношение может изменяться как при адаптации к меняющимся условиям среды, так и в ходе онтогенеза. Эмбрионы всех млекопитающих проходят стадию развития, когда митохондрии ещё не готовы к окислению субстратов. В этих условиях особенно велика роль анаэробного гликолиза. Как показано для развивающихся мышей, на стадии эмбриона основной формой фермента является тетрамер типа М4. После рождения постепенно нарабатываются другие формы ЛДГ, и к периоду, соответствующему взрослому организму, устанавливается соотношение разных изоформ, типичное для каждой ткани.
Клиническое значение определения ЛДГ
Рост общей активности ЛДГ сыворотки крови не несёт достаточно специфической информации. Можно отметить, что общая активность ЛДГ резко повышена при миелобластных и пернициозных анемиях, обширных опухолевых процессах, вирусных гепатитах, шоке и гипоксии. Выраженное повышение наблюдается при циррозах печени, обтупационных желтухах, заболеваниях почек, опорно-мышечного аппарата, опухолях, при сердечной недостаточности. Активность фермента повышается при любых патологических процессах, связанных с цитолизом клеток органов и тканей (например, при инфарктах миокарда, лейкозах, гемолитических анемиях, гепатитах и др.). Определение отдельных изоферментов ЛДГ в сыворотке крови имеет большую диагностическую значимость, чем определение суммарной активности. Активность ЛДГ1 и ЛДГ2 увеличивается при инфаркте миокарда, различных видах анемий, острых поражениях (некрозах) почечной ткани. Уровень ЛДГ1 повышается при опухолевых заболеваниях яичников. Повышение активности ЛДГ5 выявляется при повреждении скелетных мышц, любых воспалительных или дегенеративных заболеваниях скелетных мышц, многих заболеваниях печени (циррозе, всех типах гепатитов) и при раковых опухолях. Повышение активности изоферментов средней зоны, то есть ЛДГ2 и ЛДГ3 ЛДГ4 встречается при массивном разрушении тромбоцитов (эмболия лёгочной артерии, массивная гемотрансфузия) и вовлечении в патологический процесс лимфатической системы, например, при таких заболеваниях, как инфекционный мононуклеоз, лимфомы, лимфоцитарный лейкоз. У здоровых новорожденных, в первые дни жизни содержание ЛДГ2 ниже, а содержание ЛДГ5 выше чем у взрослого человека. Максимальная активность фермента наблюдается на 2-4 день жизни. К 6-7 годам соотношение фракций ЛДГ примерно соответствуют таковому у взрослого человека. Рекомендации по определению ЛДГ: 1. Сыворотка не должна быть гемолизирована, так как ЛДГ содержится в эритроцитах и результаты могут быть завышены; 2. Не рекомендуется использовать в качестве антикоагулянта оксалаты, так как соли щавелевой кислоты являются ингибиторами лактатдегидрогеназной реакции; 3. Рекомендуется использовать свежую сыворотку или плазму крови, лучше плазму, так как ЛДГ много в тромбоцитах и при их разрушении активность ЛДГ повышается.
ЛЕКЦИЯ 5.3 Энзимопатии
Энзимопатии (энзимопатологии) – общее название патологических состояний, развивающихся в результате отсутствия или снижения активности некоторых ферментов. По основной классификации все энзимопатии делят на два типа: 1. Врождённые (наследственные) энзимопатии – заболевания, в основе которых лежит генетически обусловленное отсутствие, остаток или дефектная структура какого-либо фермента. 2. Приобретённые энзимопатии – заболевания, при которых энзимные нарушения наступают вторично, в ходе патологического процесса. Кроме этого, в зависимости от клинического проявления, энзимопатии делят на три группы: 1. Энзимопатии с клиническими проявлениями; 2. Относительно бессимптомные энзимопатии; 3. Бессимптомные энзимопатии. Блок обмена веществ
Отсутствие или сильное снижение, активности энзима вызывает прерывание или замедление нормального хода данного пути обмена веществ, что называется блоком обмена веществ (метаболическим блоком). Например, на этапах А, Б, В и Г обмена веществ при врожденной энзимопатии, при которой отсутствует генетический код для синтеза энзима, превращающего В в Г, развивается блок обмена веществ:
В результате такого блока могут проявиться следующие изменения: 1. Концентрация вещества Г сильно снижается, и если это биологически важно, развиваются явления недостаточности. 2. Концентрация вещества В, а иногда и его предшественников Б и А, повышается. При токсичности этих веществ также развиваются симптомы заболевания. Иногда они могут вызвать вторичный блок обмена веществ из-за ингибирования других энзимов. 3. Если вещества А, Б и В не имеют токсического действия, а Г не имеет большого значения для организма, то блок обмена веществ может протекать бессимптомно как доброкачественная аномалия обмена веществ. 4. Концентрация В не увеличивается, если В метаболизируется по другому пути, кроме блокированного. В этих случаях образуются большие количества тех веществ (Д и Е), которые действуют токсически на клетки или ингибируют другие энзимные системы:
5. В случае, если Г может образовываться по другому метаболическому пути, симптомы его недостаточности не проявляются:
Следовательно, для постановки правильного диагноза при врожденных энзимопатиях может быть использовано определение не только активности дефектного энзима, но и концентрации накапливающихся или уменьшающихся метаболитов при блоке обмена веществ.
Примеры наследственных энзимопатий
Типичным примером наследственной энзимопатии, протекающей с клиническими проявлениями является такое заболевание, как фенилкетонурия (ФКУ) или фенилпировиноградная олигофрения. ФКУ – это наследственное заболевание, приводящее в раннем детстве к гибели ребёнка или к развитию тяжёлой умственной отсталости. Частота встречаемости составляет ≈ 1:10000 новорожденных. Молекулярный дефект болезни заключается в блокировании превращения незаменимой аминокислоты фенилаланина (Phe) в тирозин (Tyr) в соответствии с уравнением на рис.5.3.1. То есть, в этом случае организм теряет способность синтезировать фенилаланингидроксилазу. Phe тносится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтеза его бензольного кольца. Tyr является полностью заменимым при достаточном поступлении Phe с пищей. В норме избыток Phe поступившего с пищей и неиспользованный для синтеза белка, с помощью фенилаланингидроксилазы превращается в Tyr. У больных ФКУ происходит накопление Phe в тканях и крови примерно в 40 раз выше, чем в норме.
Рис. 5.3.1. Блокирование превращения незаменимой аминокислоты Phe в Tyr
Повышение содержание Phe само по себе не опасно, но стимулирует образование необычных продуктов – производных Phe – фенилпирувата и фенилацетата. Эти вещества оказывают губительное действие на развитие мозга и если не принимать необходимых мер, влекут за собой развитие умственной отсталости. Диагноз ФКУ ставят на основании химического метода открытия Phe и фенилпировиноградной кислоты на пелёнках ребёнка. Для этого используют реактивные бумажки, пропитанные FeCl3 или динитрофенилгидразином. Развитие болезни можно предотвратить, если значительно снизить исключить приём Phe с пищей с самого рождения ребёнка и в течение первых месяцев жизни. За это время мозг успевает окрепнуть, и в дальнейшем патологические продукты обмена Phe уже перестают быть опасны ми. Для такого ребёнка Tyr оказывается незаменимой аминокислотой. К относительно бессимптомным энзимопатиям относят те случаи, когда отсутствие или недостаточная активность того или иного фермента вызывает болезненные ощущения, но не угрожает жизни человека. Так, например, некоторые люди страдают непереносимостью молока, выражающейся в том, что даже небольшое количество выпитого молока приводит к расстройству кишечника. Причина такой непереносимости заключается в резком недостатке в кишечнике таких людей фермента галактозидазы, расщепляющей молочный сахар. Молочный сахар – это дисахарид лактоза, состоящий из глюкозы и галактозы. Дисахариды в кишечнике не всасываются, они должны быть предварительно разложены на свои составные части – моносахариды. Отсутствие галактозидазы делает невозможным такое разложение лактозы и тем самым препятствует её усвоению. Люди, страдающие непереносимостью молока, легко усваивают молочнокислые продукты (кефир, простоквашу и др.), в ходе приготовления которых молочный сахар разрушается. К бессимптомным энзимопатиям относят те случаи, когда отсутствие фермента изменяет внешность человека (или другие фенотипические признаки), но не нарушает сколько-нибудь важных жизненных процессов. Например, альбинизм характеризуется врождённым отсутствием пигментов в коже, волосах и сетчатке глаза. Метаболический эффект связан с потерей меланоцитами способности синтезировать тирозиназу – фермент, катализирующий окисление тирозина в диоксифенилаланин и диоксифенилаланинхинон, которые являются предшественниками меланина. При этом альбиносы по здоровью не уступают людям с нормальной окраской.
Приобретённые энзимопатии
В качестве примеров приобретённых энзмопатологий можно рассмотреть пищевые и токсические энзимопатии. К пищевым энзимопатиям можно отнести различные авитаминозы, поскольку для работы многих ферментов необходимы витамины, которые являются составной частью фермента. При недостаточном поступлении с пищей того или иного витамина нарушается работа соответствующего фермента. Это, в свою очередь проявляется клинически. Например, такое заболевание как пеллагра связано с отсутствием в пище витамина РР – никотиновой кислоты. Отсутствие или недостаток никотиновой кислоты в пище приводит к нарушению синтеза коферментов дегидрогеназ (NAD и NADF) и соответственно – к нарушению окисления основных субстратов биологического окисления. Наиболее характерными признаками авитаминоза РР, то есть пеллагры являются поражения кожи (дерматиты), поражения желудочнокишечного тракта (диарея) и нарушения нервной деятельности (деменция). К токсическим энзимопатологиям можно отнести, например, отравление таким ядом, как цианистый калий. Синильная кислота и её соли, в том числе и цианистый калий обладают способностью связывать железо важнейшего дыхательного фермента – цитохромоксидазы. Выход из строя этого фермента приводит к почти мгновенной смерти.
Энзимотерапия
Библиографический список Список основной литературы 1. Березин И.В., Клёсов А.А. Практический курс химической и ферментативной кинетики. – М.: Изд-во МГУ, 1976. – 320 с. 2. Варфоломеев С.Д. Химическая энзимология: Учебник. – М.: Издательский центр «Академия», 2005. – 480 с. 3. Диксон М., Уэбб Э. Ферменты. В 3-х тт. – М.: Мир, 1982. – 1120 с. 4. Корниш-Боуден Э. Основы ферментативной кинетики. – М.: Мир, 1979. – 277 с. 5. Кочетов Г.А. Практическое руководство по энзимологии. – М.: Высш. шк., 1980. – 272 с. 6. Курганов Б.И. Аллостерические ферменты. – М.: Наука, 1978. – 198 с. 7. Номенклатура ферментов. – М.: ВИНИТИ, 1979. – 321 с. 8. Стромберг А. Г. Физическая химия: учебник для вузов по хим. спец. Изд. 6-е, стер. – М.: Высш. шк., 2006. – 527 c. 9. Фёршт Э. Структура и механизм действия ферментов. – М.: Мир, 1980. – 432 с. 10. Фридрих П. Ферменты: четвертичная структура и надмолекулярные комплексы. – М.: Мир, 1986. – 374 с. 11. Чанг О. Физическая химия с приложениями к биологическим системам. – М.: Мир, 1980. – 662 с. 12. Enzyme Assays. A Practical Approach / Ed. R. Eisenthal, M.J. Danson. Second Edition. – Oxford: University Press, 2002. – 282 р. 13. Price N.C., Stevens L. Fundamental of Enzymology. The Cell and Molecular Biology of Catalytic Proteins. Third Edition. – Oxford, University Press, 2003. – 478 p.
Информационные ресурсы 1. Левченков С.И. Физическая и коллоидная химия [Электронный ресурс] С.И. Левченков. – Режим доступа: http://www.physchem.chimfak.rsu.ru/Source/PhCol_Lc.html 2. www.dehydrogenase.com. 3. www.ncbi.nlm.nih.gav. 4. www.molbiol.ru. 5. www.nlm.nil.gov. 6. www. high.stanford.edu.
РАЗДЕЛ 5. ПРИКЛАДНОЕ ЗНАЧЕНИЕ ФЕРМЕНТОВ ЛЕКЦИЯ 5.1.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.205.114 (0.012 с.) |






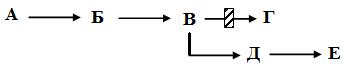

 Фенилаланин
Фенилаланин



