Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В основе классификации ферментов - тип катализируемой реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Большое число ферментов уже в начале XX века поставило перед исследователями вопросы о номенклатуре и классификации ферментов. Отличительным признаком фермента в начале XX века стало окончание «аза», которое использовали, добавляя его вначале к названию субстрата (amylum -крахмал - амилаза), а затем к названию реакции (дегидрирование - дегидрогеназы). Созданная Международным союзом химиков и биохимиков Комиссия по Ферментам (КФ) разработала основные принципы классификации и номенклатуры ферментов, которые были приняты в 1961 г. В основу классификации был положен тип катализируемой ферментом реакции. Все ферменты по этому признаку были разделены на 6 классов, в каждом из которых есть несколько подклассов. 1.Оксидоредуктазы -ферменты, которые катализируют реакции восстановления или окисления. Например алкогольдегидрогеназа, фермент, который окисляет этиловый спирт в уксусный альдегид. Второй фермент, известный как альдегиддегидрогеназа затем преобразовывает уксусный альдегид в ацетил КoA. Оксидоредуктазы часто требуют участия кофакторов, выполняющих роль промежуточных акцепторов водорода в приводимом ниже примере это НАД+.
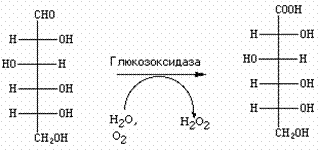
Оксидазы – разновидность оксидоредуктаз. Так называются ферменты, использующие кислород в качестве конечного акцептора водородов. Примером может служить глюкозоксидаза, которая окисляет глюкозу в глюконовую кислоту. Промежуточным акцептором водородов служит ФАД.
2.Трансферазы -ферменты, которые переносят функциональные группы от молекулы донора на молекулу акцептор. Примером могут служить метилтрансферазы, которые передает метиловую группу от S -аденозилметионина какому либо акцептору. Ниже показана реакция, катализируемая катехол-O-метилтрансферазой - ферментом, участвующим в метаболизме нейромедиаторов адреналина и норадреналина.
Еще один очень важный пример трансфераз – ферменты катализирующие перенос аминогруппы -трансаминазы.
Трансаминазы используют аминокислоту в качестве донора аминогруппы, которую они переносят на - кетокислоту, превращая соответственно аминокислоту – донор в кетокислоту и кетокислоту – акцептор в аминокислоту. Это используется для взаимопревращения некоторых аминокислот и позволяет аминокислотам вступать в пути метаболизма углеводов или липидов. Трансферазами, которые будут часто упоминаться в биохимии, являются киназы, катализирующие перенос фосфата от макроэргической молекулы АТФ на субстрат. Существует множество киназ, играющих важную роль в метаболизме клеток.
2. Гидролазы -ферменты катализирующие биологические реакции гидролиза. Они разрывают ковалентные связи. присоединяя по месту разрыва элементы воды. Липазы, фосфатазы, ацетилхолинэстераза и протеазы - все это примеры гидролитических ферментов.
4. Лиазы (десмолазы) –ферменты, которые катализируют распад C-C, C-O и C-N связями негидролитическим путем с образованием двойных связей. Примером может быть фермент ДОФА декарбоксилаза, которая является ключевым ферментом в синтезе биогенных аминов адреналина и норадреналина.
5. Изомеразы - ферменты, которые катализируют внутримолекулярные перегруппировки. При этом происходит взаимопревращение оптических геометрических и позиционных изомеров. Эпимеразы и рацемазы - примеры ферментов этого класса.
6. Лигазы катализируют образование C-O, C-S, C-N или C-C связей, используя энергию гидролиза АТФ. Фосфат может или не может ковалентно связываться с продуктом реакции.
Комиссия по ферментам предложила и принципы номенклатуры ферментов. Рекомендуется использовать систематическую и рабочую номенклатуры. В основу систематической номенклатуры положен тот же принцип, что и для классификации – тип катализируемой реакции. На первый взгляд названия при этом становятся громоздкими, но зато из названия становится ясным, что делает фермент. Название состоит из двух частей: названия участников реакции (в зависимости от класса это могут быть субстраты, промежуточные акцептоы) и типа катализируемой реакции с окончанием «аза». Каждый фермент получает специфический кодовый номер-шифр фермента, отражающий его положение в классификации: первая цифра характеризует класс фермента, вторая –подкласс и третья подподкласс. Каждый подподкласс представляет собой список ферментов. Порядковый номер фермента в этом списке – четвертая цифра кода. На рис 1-1 показан шифр креатинфосфокиназы – КФ.2.7.3.2. Этот фермент катализирует реакцию фосфорилирования креатина. Систематическое название фермента АТФ: креатинфосфотрансфераза. Рабочее название этого фермента креатинкиназа или креатинфофокиназа
Шифр креатинфосфокиназы и место фермента в классификации ферментов 2. Изоферменты, их природа, биологическая роль, строение ЛДГ. Полиферментные комплексы, метаболоны. Изоферменты - это группа родственных ферментов, катализирующих одну и ту же реакцию. Они происходят из одного предшественника за счет дупликациии гена с последующей мутацией образуемых аллелей. Они отличаются между собой: 1) скорстью катализа; 2) направлением катализируемой реакции; 3) условиями протекания реакции; 4) чувствительностью к регуляторам, факторам среды. (Более или менее устойчивы к ингибиторам); 5) сродством к субстрату; 6) особенностями структуры молекулы, ее ИЭТ, Mr, размерами и зарядом. Изоферменты имеют адаптивное значение, т. е. придают специфику метаболизма. Изоферменты обеспечивают межорганную связь, например, в процессе мышечной деятельности. В миокарде и печени существуют различные изоферменты ЛДГ, которые обеспечивают метаболизм лактата: ЛДГ4,5 в печени: ПВК -----> лактат ЛДГ1,2 в сердце: лактат ------> ПВК ЛДГ - олигомерный фермент, состоящий из 4-х субъединиц 2 типов. H (heart) и M (muscle). Существует 5 изоферментных форм: HHHH HHHM HHMM HMMM MMMM H4 H3M H2M2 HM3 M4 ЛДГ1, ЛДГ2, ЛДГ3, ЛДГ4, ЛДГ5. Поскольку H-протомеры несут более выраженный отрицательный заряд, то изофермент H4 (ЛДГ1) будет мигрировать при электрофорезе с наибольшей скоростью к аноду. С наименьшей скоростью к аноду будет двигаться М4. Остальные изоферменты занимают промежуточное положение. Изоферменты ЛДГ локализованы в различных тканях:
ЛДГ1,2 ----> мозг, аэробные ткани (миокард). ЛДГ3 ----> лейкозные клетки. ЛДГ4,5 ----> анэробные ткани: мышечная, скелетная. Изоферменты появляются на различных этапах онтогенеза и реализуют программу индивидуального развития. Изоферментный профиль меняется в процессе развития. При патологиях имеется существенный изоферментный сдвиг. Метаболон – мультиферментный комплекс, состоящий из белков-ферментов обладающих всеми уровнями структурной организации и катализирующих отдельные метаболические пути. Эти комплексы обычно связаны с клеточными мембранами, играют важную роль в эволюции живых систем, поскольку обеспечивают высокую скорость катализа, тонкую, точную регуляцию и направленность (векторность) метаболизма во времени и пространстве. В промежуточном метаболизме имеются мультиферментные комплексы, катализирующие сложную многостадийную реакцию окислительного декарбоксилирования 2-кетокислот и переноса образующегося ацильного остатка на кофермент А. В качестве акцептора электронов выступает НАД+. Кроме того, в реакции участвуют тиаминдифосфат, липоамид и ФАД. К дегидрогеназам кетокислот относятся:
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 436; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.72.220 (0.009 с.) |