
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила отбора. Спектры атомовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Знаем, что испускание и поглощение света происходит при переходах электрона с одного уровня на другой. При этом атом может поглотить или испустить только фотон с энергией, равной разности энергий соответствующих уровней. А поскольку фотон обладает собственным моментом импульса, то переходы могут осуществляться только между такими энергетическими уровнями, для которых будет справедлив закон сохранения момента импульса системы «фотон-электрон». Это сводится к так называемым правилам отбора: электрон может совершить только такой переход, при котором орбитальное и магнитное квантовые числа меняются на единицу:
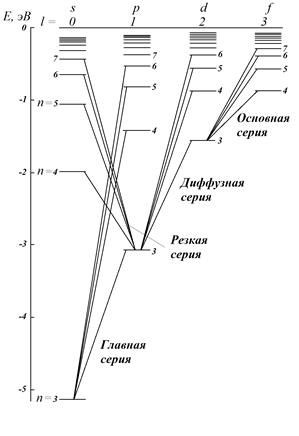
Все разрешенные этими правилами переходы составляют спектр поглощения (для переходов с увеличением l) или спектр излучения (для переходов с уменьшением l). Переходы с изменением ml также будут происходить, но поскольку это квантовое число практически не влияет на значение энергии соответствующего состояния, то по величине энергии различить между собой эти переходы невозможно (по крайней мере в отсутствие сильных магнитных полей). Так, например, переход из состояния (l = 1, ml = 3) в состояние (l = 1, ml = 3) и переход из состояния (l = 2, ml = 2) в состояние (l = 2, ml = 3) будут неотличимы для спектроскописта. Согласно указанным правилам отбора, в атоме водорода (как и в любом атоме) возможны серии переходов. Атом водорода для рассмотрения различных серий не очень нагляден, так как в его спектре некоторые серии совпадают – т.е. линии в этих сериях имеют одинаковые значения энергий (например серия Бальмера на рис. 7.4 – это три совпадающие серии). Подобные серии в других атомах объединены по квантовым числам n и l. Квантовые числа нижнего состояния nнижн и lнижн фиксируются (на рис. 7.5, например, состояние с nнижн = 3, lнижн = 1). Верхнее состояние может иметь любое n, но не меньше nнижн (для выбранной в качестве примера серии nверхн = 3, 4, 5,...).
Рис. 7.4. Схема энергетических состояний Рис. 7.5. Схема энергетических состояний и переходов атома H и переходов атома Na При этом для верхнего состояния согласно правилам отбора lверхн должно отличаться от lнижн на единицу (больше или меньше). В рассматриваемом случае переходы из состояний с lверхн = 0 объединены в «резкую» серию, а переходы из состояния с lверхн = 2 – в «диффузную серию». Переходы из состояний с lверхн ≠ 0 или 2 в состояние с lнижн = 0 являются запрещенными (в спектрах атомов линии, соответствующие таким переходам, не наблюдаются). Спектры атомов щелочных металлов очень похожи на спектр атома водорода. Это сходство позволяет предположить, что спектры щелочных атомов обусловлены переходами самого внешнего валентного электрона. Рассмотрим в качестве примера спектр атома натрия. Он также состоит из нескольких серий линий, сгруппированных по квантовым числам n и l (рис. 7.5). Состояния, в которых может находиться электрон, в спектроскопической терминологии принято обозначать следующим образом: l = 0 s-состоянием, l = 1 p-состоянием, l = 2 d- состоянием, и так далее f -, g -, h-состояниями. Электроны, находящиеся в состояниях с соответствующими значениями момента импульса, называют s-, p-, d-, f-, g-, h-электронами. Электрон в состоянии, например с n = 3и l = 1обозначается символом 3 p. С этими обозначениями вы уже встречались в курсе школьной химии, без объяснения причин было сказано, что в атоме существуют так называемые s-, p-, d-орбитали. Возникновение этих индексов связано с названием серий линий в спектрах атомов. Рассмотрим рис. 7.5. Самая большая энергия соответствует переходам главной серии – она складывается из переходов между основным состоянием атома (для Na это состояние с n = 3, l = 0) и состояниями с различными n ≥ 3 при l = 1. С английского главный – principal, по первой букве серия получила обозначение p. Таким образом, состояния с l = 1, задействованные в этой серии получили общее обозначение p. Соответственно резкая серия и состояния с l = 0 обозначены s по первой букве английского слова sharp; диффузная (или размытая) серия и состояния с l = 2 – d по слову diffuse; основная серия и состояния с l = 3 – f по слову fundamental и т.д.. Пользуясь условными спектроскопическими обозначениями, напомним, что переходы, составляющие серию Лаймана в спектре водорода, можно записать в виде: Серии Бальмера в свою очередь соответствуют переходы
и так далее. Состояние 1 s является основным состоянием атома водорода, в этом состоянии атом обладает минимальной энергией. У любой частицы существует единственное основное состояние, возбужденных состояний существует неограниченное множество. Как было сказано в лекции 3, наблюдать экспериментально можно только ограниченное число линий в спектре, т.е. ограниченное число возбужденных состояний. Чтобы перевести атом в возбужденное состояние, ему необходимо сообщить дополнительную энергию. Это может быть осуществлено за счет теплового соударения атомов или за счет столкновения атома с достаточно быстрым электроном, или за счет поглощения атомом фотона. Фотон при поглощении веществом исчезает, передавая всю свою энергию атому. Поглощение части энергии фотона не может произойти, так как он является неделимой и неизменяемой частицей (элементарной, так же как электрон и многие другие). Процесс поглощения является резонансным – это означает, что поглотится может только такой фотон, энергия которого совпадает с разницей энергий двух уровней, между которыми происходит переход. С учетом введенных обозначений спектр поглощения атома водорода в основном состоянии должен состоять из линий, соответствующих переходам
При получении соответствующей энергии, атом переходит в одно из состояний с n > 1, которые называются возбужденными. Поглощение происходит даже если атом уже находится в возбужденном состоянии – в этом случае атом совершает переход в более высокое возбужденное состояние. Если получаемая энергия больше определенного значения, атом становится ионизованным, то есть потерявшим самый слабосвязанный электрон. Энергия, необходимая для отрыва этого электрона, называется энергией ионизации (для атома водорода это Ei = 13.55 эВ).
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1411; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 (7.12)
(7.12) (7.13)
(7.13)
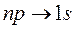 (n = 2, 3,...),
(n = 2, 3,...),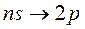 ,
, 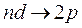 и
и 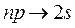 (n = 3, 4,...)
(n = 3, 4,...)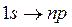 (n = 2, 3,...)
(n = 2, 3,...)


