
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спектры водородоподобных атомовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Вопросы: 1 Строение атома водорода и водородоподобных атомов. 2 Схема уровней в энергетическом спектре атома водорода. 3 Серии спектральных линий атома водорода и соответствующие им области шкалы электромагнитных волн. 4 Зависимость энергии квантовых состояний атома водорода от главного квантового числа. 5 Формула Бальмера.
Принятые обозначения: · · ·
Основные формулы: · Формула Бальмера для атома водорода:
где · Обобщенная формула Бальмера:
где · Формулы, связывающие длину волны, частоту и циклическую частоту Задачи
1 Сколько спектральных линий будет испускать атомарный водород, который возбуждают на 2 Найти наименьшую 3 Какие линии содержит спектр поглощения атомарного водорода в диапазоне длин волн от 94,5 до 130 нм? 4 Какую наименьшую энергию 5 В каких пределах должны лежать длины волн l монохроматического света, чтобы при возбуждении атома водорода квантами этого света наблюдались три спектральные линии? 6 На дифракционную решетку нормально падает пучок света от разрядной трубки, наполненной атомарным водородом. Постоянная решетки 7 Вычислить постоянную Ридберга, если известно, что для ионов 8 Найти длину волны головной линии той спектральной серии ионов 9 Энергия связи электрона в основном состоянии атома гелия равна 10 Покоившийся атом водорода испустил фотон, соответствующий головной линии серии Лаймана. Какую скорость приобрел атом? 11 Покоящийся ион
Ответы 1.
Свойства атомов
Вопросы: 1 Принцип Паули. 2 Связь периодичности структуры электронных оболочек атомов с периодической таблицей элементов Менделеева. 3 Электронные слои атомов и их обозначения. 4 Термы атомов и их обозначения. 5 Квантовые числа: главное, орбитальное, магнитное, спиновое и полного момента. 6 Механические моменты атома. 7 Правила отбора при излучении атомов. 8 Правила Хунда.
Принятые обозначения: · · · · · ·
Основные формулы: · Спектральные обозначения термов: где · Орбитальный механический момент атома:
· Спиновой механический момент атома:
· Полный механический момент атома:
· Мультиплетность: · Правила отбора для квантовых чисел · · Правила Хунда: а) наименьшей энергией обладает терм с максимальным значением спинового квантового числа б) орбитальное квантовое число в) внутреннее квантовое число
Задачи
1 Выписать спектральные о6означения термов атома водорода, электрон которого наводится в состоянии с главным квантовым числом n =3. 2 Найти возможные значения полных механических моментов атомов, находящихся в состояниях: а) 3 Выписать спектральные символы термов двухэлектронной системы, состоящей из одного 4 Найти возможные мультиплетности 5 Некоторый атом, кроме заполненных оболочек, имеет три электрона 6 Сколько различных типов термов возможно у двухэлектронной системы, состоящей из 7 Найти угол между спиновым и полным механическими моментами в векторной модели атома, содержащего кроме заполненных подоболочек три электрона 8 Найти с помощью правил Хунда полный механический момент атома в основном состоянии, если его незаполненная подоболочка содержит: а) три d-электрона; б) семь d-электронов. 9 Воспользовавшись правилами Хунда, найти число электронов в единственной незаполненной подоболочке атома, основной терм которого: а) 3F2; б) 2P3/2; в)6S5/2; 10 Установить, какие из нижеперечисленных переходов запрещены правилами отбора: 2 D3/2
Ответы 1.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1696; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.26.141 (0.006 с.) |

 – постоянная Ридберга..
– постоянная Ридберга.. – главное квантовое число,
– главное квантовое число,  .
. − зарядовое число.
− зарядовое число.
 − длина волны, излучаемая при переходе между уровнями с главными квантовыми числами
− длина волны, излучаемая при переходе между уровнями с главными квантовыми числами  и
и  ,
,  – постоянная Ридберга для атома водорода.
– постоянная Ридберга для атома водорода. ,
, − постоянная Ридберга,
− постоянная Ридберга,  − циклическая частота спектральной линии.
− циклическая частота спектральной линии. .
. и наибольшую
и наибольшую  длины волн спектральных линий водорода в видимой области спектра.
длины волн спектральных линий водорода в видимой области спектра. (в электронвольтах) должны иметь электроны, чтобы при возбуждении атомов водорода ударами этих электронов появились все линии всех серии спектра водорода? Какую наименьшую скорость
(в электронвольтах) должны иметь электроны, чтобы при возбуждении атомов водорода ударами этих электронов появились все линии всех серии спектра водорода? Какую наименьшую скорость  должны иметь эти электроны?
должны иметь эти электроны?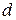 = 5 мкм. Какому переходу электрона соответствует спектральная линия, наблюдаемая при помощи этой решетки в спектре пятого порядка под углом j = 41°?
= 5 мкм. Какому переходу электрона соответствует спектральная линия, наблюдаемая при помощи этой решетки в спектре пятого порядка под углом j = 41°? , разность длин волн между головными линиями серии Бальмера и Лаймана составляет 133,7 нм.
, разность длин волн между головными линиями серии Бальмера и Лаймана составляет 133,7 нм.
 . Найти энергию, необходимую для удаления обоих электронов из этого атома.
. Найти энергию, необходимую для удаления обоих электронов из этого атома. где n = 1, 2, 3,… 2. 365 нм; 656 нм. 3. 121,6 нм; 102,6 нм; 97,3 нм. 4. 13,6 эВ; 2,2 Мм/с. 5. (102,3¸121,5) нм. 6. n1=2, n2=3. 7. 2,07 1016 1/ c. 8. 0,47 мкм. 9. 7,9 эВ. 10. 6 км/с. 11. 3,1 106 м/с.
где n = 1, 2, 3,… 2. 365 нм; 656 нм. 3. 121,6 нм; 102,6 нм; 97,3 нм. 4. 13,6 эВ; 2,2 Мм/с. 5. (102,3¸121,5) нм. 6. n1=2, n2=3. 7. 2,07 1016 1/ c. 8. 0,47 мкм. 9. 7,9 эВ. 10. 6 км/с. 11. 3,1 106 м/с. – орбитальное квантовое число.
– орбитальное квантовое число. – спиновое квантовое число.
– спиновое квантовое число. – внутреннее квантовое число.
– внутреннее квантовое число. − мультиплетность.
− мультиплетность. – орбитальный, спиновой и полный механический моменты.
– орбитальный, спиновой и полный механический моменты. 
 ,
, – буквенный символ орбитального квантового числа L=0,1,2,3,4,5,6,…(n-1), а соответствующий буквенный символ:
– буквенный символ орбитального квантового числа L=0,1,2,3,4,5,6,…(n-1), а соответствующий буквенный символ:  .
. .
. .
. .
. .
. :
: .
. должно быть наибольшим;
должно быть наибольшим; , если подоболочка заполнена не более, чем наполовину, и по формуле
, если подоболочка заполнена не более, чем наполовину, и по формуле  , если подоболочка заполнена более, чем наполовину.
, если подоболочка заполнена более, чем наполовину. и б)
и б)  .
. -электрона и одного
-электрона и одного 
 и находится в состоянии с максимально возможным для этой конфигурации полным механическим моментом. Найти в соответствующей векторной модели атома угол между спиновым и полным механическим моментом данного атома.
и находится в состоянии с максимально возможным для этой конфигурации полным механическим моментом. Найти в соответствующей векторной модели атома угол между спиновым и полным механическим моментом данного атома. -электронов?
-электронов? и имеющего максимально возможный для этой конфигурации полный механический момент.
и имеющего максимально возможный для этой конфигурации полный механический момент. 2Р1/2, 2Р1
2Р1/2, 2Р1  2.
2. 



 3. 1P1; 3P0,1,2; 1D2; 3D1,2,3; 1F3; 3F2,3,4. 4. 1, 3, 5, 7, 9; 2, 4, 6; 3, 7, 9. 5. 31o. 6. 1P1, 1D2, 1F3, 1G4, 1H5, 3P0,1,2, 3F2,3,4, 3G3,4,5, 3H4,5,6. 7. 34,4o 8.
3. 1P1; 3P0,1,2; 1D2; 3D1,2,3; 1F3; 3F2,3,4. 4. 1, 3, 5, 7, 9; 2, 4, 6; 3, 7, 9. 5. 31o. 6. 1P1, 1D2, 1F3, 1G4, 1H5, 3P0,1,2, 3F2,3,4, 3G3,4,5, 3H4,5,6. 7. 34,4o 8.  . 9. 2d – электрона; 5p – электронов; 5d – электронов. 10. 2-й и 3-й переходы.
. 9. 2d – электрона; 5p – электронов; 5d – электронов. 10. 2-й и 3-й переходы.


