
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 1. Определение ионов кальция и магния при совместном присутствии в раствореСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Суммарное содержание ионов кальция и магния в растворе (ммоль/л) характеризует общую жесткость воды. Комплексонометрическое титрование основано на реакциях образования комплексов ионов металлов с этилендиаминтетраацетатом натрия (ЭДТА). Конечную точку титрования (КТТ) определяют с помощью металлоиндикаторов – органических соединений, которые образуют с металлами окрашенные комплексные соединения. КТТ устанавливают фотометрически при выбранном светофильтре. Раздельное определение ионов кальция и магния основано на титровании их смеси раствором ЭДТА при различном значении рН среды. Титрование суммы ионов Ca2+ и Mg2+ проводят в среде аммиачного буферного раствора (рН 9 – 10), добавив металллоиндикатор – кислотный хром синий К. Анион этого реагента, обозначенный H2Ind3–, имеет в щелочной среде голубую окраску. С катионами металлов Ме2+ (Ca2+ и Mg2+) он образует комплексы розового цвета:
Ме2+ + H2Ind3– ↔ МеInd3– + 2Н+. бесцветный голубой розовый
При титровании раствором ЭДТА (H2Y2–) ионы металлов связываются титрантом в более прочное, чем МеInd3–, комплексное соединение:
Ме2+ + H2Y2– ↔ МеY2– + 2Н+.
Вблизи точки эквивалентности, когда все свободные ионы металлов практически связаны в комплексонат, разрушается комплекс металлов с индикатором. Анионы индикатора переходят в раствор, окрашивая его в точке эквивалентности в голубой цвет, свойственный свободному индикатору:
МеInd– + H2Y2– ↔ МеY2– + Н2Ind3–. розовый голубой
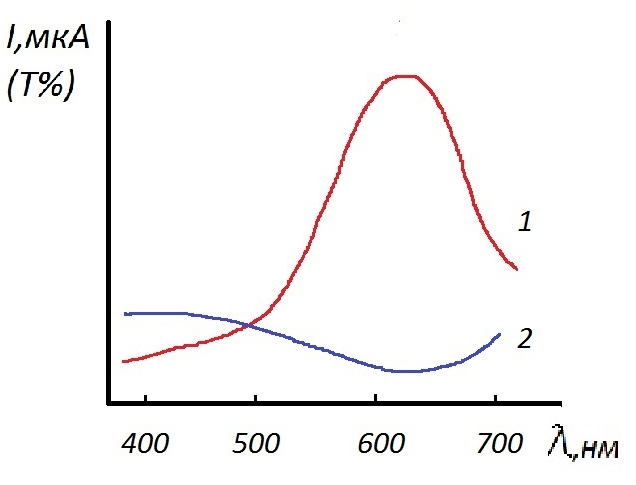
При рН ≥ 12 (для этого к пробе анализируемого раствора добавляют раствор NaOH) в присутствии индикатора мурексида в реакцию с ЭДТА вступает только кальций. Разность объемов титранта ЭДТА, затраченных на титрование при различных рН соответствует объему ЭДТА, пошедшему на титрование магния. Титрование проводят при определенной длине волны, выбранной по спектрам поглощения (рисунок 2.6).
Рисунок 2.6 – Спектры поглощения титруемого раствора до начала титрования (1) и после точки эквивалентности (2)
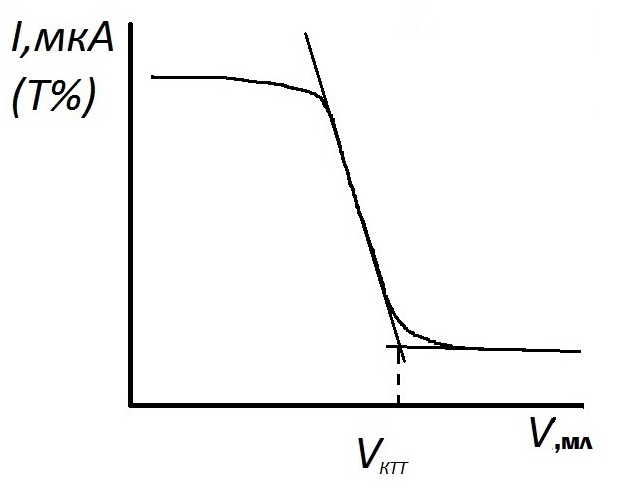
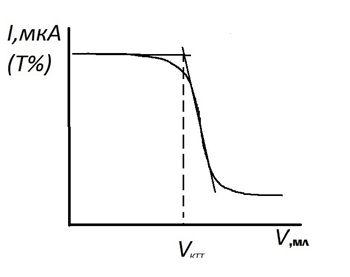
Кривая фотометрического титрования кальция и магния раствором ЭДТА в присутствии металлоиндикатора будет иметь вид, показанный на рисунке 2.7. Характер кривой титрования можно объяснить следующим образом. До начала титрования раствор имеет розовую окраску и практически не поглощает свет при выбранном светофильтре, значит пропускание или фототок велики (кривая 1, рисунок 2.6). Вблизи точки эквивалентности раствор начиняет изменять окраску и в точке эквивалентности становится голубым. Голубой раствор поглощает свет при выбранном светофильтре (кривая 2), поэтому вблизи точки эквивалентности наблюдается резкое изменение оптической плотности и, соответственно, фототока. При дальнейшем прибавлении титранта оптическая плотность раствора практически не изменяется.
Рисунок 2.7 – Кривая фотометрического титрования ионов Mg раствором ЭДТА в присутствии индикатора кислотного хром синего К
Цель работы: Определение содержания ионов кальция и магния в растворе методом фотометрического титрования; оценка правильности и воспроизводимости результатов определения. Реактивы, посуда, приборы Раствор ЭДТА (трилон Б), ~ 0,1 М. Стандартный раствор Mg2+ , ~ 0,1000 М. Аммиачный буферный раствор (рН 10). Кислотный хром синий К, спиртовой 0,5 %–й раствор. Раствор NaOH, 20 %–й. Мурексид (смесь с NaCl в соотношении 1: 100). Стакан для титрования с размешивателем. Бюретка для титрования вместимостью 25,00 мл. Пипетки вместимостью 10,0 мл. Мерные колбы вместимостью 100,0 и 250,0 мл. Фотоэлектрический титратор Т-107.
Выполнение работы Определение суммарного содержания Ca 2+ и Mg 2+ (общей жесткости) 1. Выбор светофильтра для титрования суммы ионов Ca 2+ и Mg 2+ Приготовьте в стаканах для титрования два раствора: № 1 – к 10-20 мл раствора соли Mg2+, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачной буферной смеси и дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Розовая окраска раствора обусловлена образования комплекса МеInd3-. № 2 – к 10-20 мл раствора соли Mg2+, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачной буферной смеси и избыток раствора ЭДТА до появления голубой (синей) окраски. Доливают дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Далее проводят измерения интенсивности поглощения на титраторе Т-107 в следующем порядке: – устанавливают «0» по воздуху при закрытой шторке (корректор помещают слепым концом вниз); – шторку открывают, переворачивая корректор прорезью вниз, и по воздуху устанавливают значение микроамперметра в диапазоне «80 – 90» барабаном (раздвижной шторкой грубой регулировки); – устанавливают светофильтр № 1; – в кюветное отделение поочередно устанавливают стаканы с растворами № 1 и № 2 и записывают соответствующие показания фототока; – эти операции выполняют последовательно со всеми светофильтрами №№ 2–5. Показания измерений записывают в таблицу 2.9.
Таблица 2.9 – Выбор светофильтра для фотометрического титрования
Результаты измерений наносят на один график в координатах «пропускание – длина волны (№ светофильтра) и по спектрам выбирают тот светофильтр, которому соответствует максимальная разность величин пропускания (показания фототока). Пример спектров поглощения приведен на рисунке 2.6.
2. Приготовление титранта Титрант готовят разбавлением более концентрированного раствора. Рассчитывают, какой объем стандартного ~ 0,1 М раствора ЭДТА V 1, необходимо для приготовления 250 мл 0,005 М раствора ЭДТА, используя выражение C 1 V 1 = C 2 V 2,
Полученное значение объема округляют до целого количества мл. Необходимый объем раствора пипеткой переносят в колбу, доводят до метки дистиллированной водой и тщательно перемешивают. 3. Приготовление стандартного раствора магния Стандартный раствор магния используют для стандартизации приготовленного раствора ЭДТА. Стандартный раствор магния концентрации ~ 0,005000 моль/л готовят путем разбавления более концентрированного исходного стандартного ~ 0,1 М раствора в мерной колбе вместимостью 100,0 мл. Предварительно рассчитывают объем исходного раствора V 1, который необходим для приготовления. Полученное значение объема округляют до целого количества мл. Необходимый объем раствора пипеткой переносят в мерную колбу, доводят до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрацию приготовленного стандартного раствора магния с точностью до 4–х значащих цифр.
4. Установление концентрации титранта ЭДТА Раствор титранта заливают бюретку. В стакан для титрования пипеткой отбирают 10,00 мл приготовленного стандартного раствора магния, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачного буферного раствора и дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Проводят титрование раствором ЭДТА согласно методике измерений, описанной выше (см. раздел. 2.2.1), установив выбранный светофильтр. Титрант прибавляют по 0,5 мл, записывая каждый раз значение фототока в таблицу 2.10. После резкого скачкообразного изменения фототока выполняют еще 4 – 5 измерений. Титрование стандартного раствора Mg2+ повторяют 3 раза. По результатам каждого титрования строят кривую титрования на миллиметровой бумаге в координатах I = f (V титранта) в масштабе: по оси абсцисс 2 см – 1 мл, а по оси ординат 2 см – 10 или 20 мкА. Определяют объем титранта в КТТ, как указано на рисунке 2.7. Кривые строят на одном листе, сдвигая их начало по оси абсцисс на 2 см.
Таблица 2.10 – Результаты титрования стандартного раствора Mg2+
Концентрацию титранта рассчитывают с точностью до 4–х значащих цифр:
где С (Mg2+)ст – концентрация стандартного раствора магния, моль/л; V ст – объем стандартного раствора магния, мл; V КТТ – объем раствора титранта, затраченный на реакцию с ионами магния, мл. Результаты установления концентрации титранта представляют в виде таблицы 2.11 и находят среднее значение величины С (ЭДТА). Таблица 2.11 – Установление концентрации титранта ЭДТА
5. Определение содержания Ca2+ и Mg2+ в анализируемом растворе Рассчитывают ~ объем пробы анализируемого раствора для титрования. Для отбора пробы выбирают пипетку, вместимость которой близка к рассчитанному значению (см. раздел 2.2.2). В стакан для титрования мерной пипеткой отбирают пробу анализируемого раствора V п, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачной буферной смеси. Доливают дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Устанавливают выбранный светофильтр. Проводят титрование раствором ЭДТА согласно методике измерений, описанной выше (см. раздел 2.2.1). Титрант прибавляют по 0,5 мл, записывая каждый раз значение фототока по форме таблицы 2.10. После резкого скачкообразного изменения фототока выполняют еще 4 – 5 измерений. Проводят не менее трех параллельных титрований анализируемого раствора. По результатам каждого титрования строят кривую титрования на миллиметровой бумаге в координатах I = f (V титранта). Определяют объем титранта в КТТ (V КТТ), затраченный на титрование суммы кальция и магния, как указано на рисунке 2.7. Кривые строят на одном листе, сдвигая их начало по оси абсцисс. Общее содержание ионов Ca2+ и Mg2+ рассчитывают с точностью до 4–х значащих цифр по формуле:
Результаты определения представляют в виде таблицы 2.12. Таблица 2.12 – Результаты определения содержания (Ca2+ + Mg2)
Определение содержания ионов Ca 2+ в растворе 6. Выбор светофильтра для титрования ионов Ca 2+ В стаканах для титрования готовят два раствора: № 1 – к 10-20 мл исследуемого раствора, прибавляют 1 мл раствора NaOH, вносят на кончике шпателя индикатор мурексид. Раствор хорошо перемешивают до полного растворения индикаторной смеси и разбавляют дистиллированной водой до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Красная окраска раствора обусловлена образования комплекса CaInd3–. № 2 – к 10-20 мл раствора прибавляют 1 мл раствора NaOH, вносят на кончике шпателя индикатор мурексид. Раствор хорошо перемешивают до полного растворения индикаторной смеси и приливают избыток раствора ЭДТА до появления фиолетовой окраски. Доливают дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Приготовленные растворы фотометрируют на титраторе Т-107 при всех светофильтрах. Показания измерений записывают в виде таблицы 2.9. Для обоих растворов на одном графике строят спектры поглощения и выбирают светофильтр, при котором наблюдается максимальная разность величин пропускания.
7. Определение содержания Ca2+ в анализируемом растворе В стакан для титрования мерной пипеткой отбирают пробу анализируемого раствора V п, прибавляют 1 мл раствора NaOH, вносят на кончике шпателя индикатор мурексид. Раствор хорошо перемешивают до полного растворения индикаторной смеси и разбавляют дистиллированной водой до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. На титраторе устанавливают выбранный светофильтр. Проводят титрование раствором ЭДТА согласно методике измерений, описанной выше (см. раздел 2.2.1). Титрант прибавляют по 0,5 мл, записывая каждый раз значение фототока по форме таблицы 2.10. После резкого изменения фототока выполняют еще 4 – 5 измерений. Титрование анализируемого раствора повторяют не менее трех раз. По результатам каждого титрования строят кривую титрования на миллиметровой бумаге в координатах I = f (V титранта). Определяют объем титранта в КТТ (V КТТ), затраченный на титрование ионов кальция. Кривые строят на одном листе, сдвигая их начало по оси абсцисс. Cодержание ионов Ca2+ рассчитывают по формуле:
Результаты определения записывают в таблицу 2.13. Таблица 2.13 – Результаты определения содержания Ca2+
8. Определение содержания Mg 2+ в анализируемом растворе По результатам параллельных определений рассчитывают средние значения объема титранта ЭДТА, израсходованного на титрование суммы ионов кальция и магния V 1 и титрование только ионов магния V 2. Объем титранта ЭДТА, затраченный на титрование ионов магния, находят как разность объемов V 1 – V 2. По закону эквивалентности рассчитывают концентрацию ионов магния в растворе в ммоль/л и мг/л.
9. Оценка воспроизводимости и правильности результатов Математическую обработку результатов определения С (Ca2++Mg2+) и С (Ca2+), ммоль/л проводят в соответствии с рекомендациями [1, с.11]. Результаты расчетов с необходимым числом значащих цифр представляют в виде таблицы 2.13.
Таблица 2.14 – Математическая обработка результатов анализа
Работа 2. Определение ионов Fe2+ в растворе Цель работы:Определение содержания ионов железа(ll) в растворе методом фотометрического титрования; оценка правильности и воспроизводимости результатов определения.
Определение железа (ll) основано на титровании его раствором перманганата калия в кислой среде. При титровании протекает реакция
MnO4– + 5Fe2+ + 8H+ ↔ Mn2+ + 5Fe3+ + 4H2O.
Титруемый раствор остается бесцветным до тех пор, пока в нем не исчезнут ионы железа (ll), так как весь прилитый окрашенный раствор КMnO4 вступает в реакцию с Fe2+, а продукты реакции не поглощают свет в видимой части света. После достижения точки эквивалентности избыток титранта КMnO4 окрасит раствор в розовый цвет, что вызовет поглощение света в области 540 нм. Дальнейшее прибавление титранта будет увеличивать оптическую плотность раствора. Так как в фотометрическом титраторе Т–107 измеряется сила фототока I, пропорциональная светопропусканию Т, кривая титрования будет иметь вид, представленный на рисунке 2.8. Конечную точку титрования устанавливают как точку пересечения линейных участков кривой титрования.
Рисунок 2.8 – Кривая фотометрического титрования железа (ll) раствором перманганата калия Реактивы, посуда, приборы Раствор КMnO4 концентрации С (1/5КMnO4) ~ 0,1 моль/л. Стандартный раствор соли Мора с C (Fe(NH4)2(SO4)2) ~ 0,1000 моль/л. Раствор H2SO4, ~ 2 моль/л. Стакан для титрования с размешивателем. Бюретка вместимостью 25,00 мл. Пипетка вместимостью 10,00 мл. Мерная колба вместимостью 100,0 мл. Склянка вместимостью 250 мл. Фотоэлектрический титратор. Порядок выполнения работы
1. Выбор светофильтра 1) В стаканах для титрования готовят два раствора: № 1 (бесцветный) – к 10 -20 мл раствора соли Мора, содержащей ионы Fe2+, прибавляют дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. № 2 (розовый) – к 10-20 мл раствора соли Мора, прибавляют раствор КMnO4, чтобы раствор в стакане приобрел розовую окраску. Доливают дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. 2) Устанавливают «0» по воздуху при закрытой шторке (корректор помещают слепым концом вниз). 3) Шторку открывают, переворачивая корректор прорезью вниз, и по воздуху устанавливают значение микроамперметра в диапазоне «80 – 90» барабаном (раздвижной шторкой грубой регулировки). 4) Устанавливают светофильтр № 1. 5) В кюветное отделение поочередно устанавливают стаканы с растворами № 1 и № 2 и записывают соответствующие показания фототока. 6) Операции п.2-5 выполняют последовательно со всеми светофильтрами №№ 2-5. 7) Результаты измерений наносят на график: пропускание – длина волны (№ светофильтра) и выбирают тот светофильтр, которому соответствует максимальная разность величин пропускания.
2. Приготовление раствора титранта КMnO4 и установление его концентрации Раствор титранта С (1/5КMnO4) ~ 0,01 моль/л готовят путем разбавления более концентрированного ~ 0,1 н раствора в склянке вместимостью 200 - 250 мл. Для этого мерным цилиндром или мензуркой отмеряют необходимое количество концентрированного раствора перманганата калия, переносят его в склянку и добавляют 200 – 250 мл дистиллированной воды. В лабораторном журнале выполняют все необходимые расчеты. Фотометрическое титрование стандартного раствора соли Мора проводят раствором перманганата калия. Для этого в стакан для титрования отбирают пипеткой (или бюреткой) 10,00 мл стандартного ~ 0,1000 М раствора соли Мора, прибавляют ~ 10 мл 2 М раствора H2SO4 и такое количество дистиллированной воды, чтобы при титровании световой поток проходил через раствор. Вводят в световой поток необходимый светофильтр переключателем (5). Помещают корректор (3) слепым концом вниз и нажимают кнопку «М 1:1» переключателем рода работ (10). Ручкой (11) устанавливают стрелку микроамперметра (2) на «0». Поворачивая корректор прорезью вниз и подвижной шторкой грубой регулировки чувствительности (4) и ручкой точной регулировки чувствительности (9) выставляют стрелку микроамперметра (2) на деление в диапазоне 80 – 90 мкА. В держатель кюветного блока (6) устанавливают стакан с раствором, опустив в него размешиватель. Кнопкой «мешалка» (7) включают мешалку и ручкой обороты (8) устанавливают такую частоту вращения мешалки, чтобы дно воронки было выше светового потока на 5 – 7 мм. Закрывают крышку кюветного отделения (6) и вставляют в отверстие крышки капилляр бюретки. Проводят титрование, прибавляя по 0,5 мл раствора титранта. Измеряют объем прибавленного титранта и показания микроамперметра. После того как сила фототока заметно уменьшится, необходимо получить не менее 5 точек. Результаты титрования записывают в лабораторный журнал в виде таблицы 2.10. Проводят три параллельных титрования. Для каждого титрования строят кривую титрования и находят объем титранта в КТТ по точке пересечения линейных участков кривых титрования. Кривые строят на одном листе, сдвигая их начало по оси абсцисс. Концентрацию титранта с точностью до 4–х значащих цифр для каждого титрования рассчитывают по формуле:
где С (Fe2+)ст – концентрация стандартного раствора соли Мора, моль/л; V ст – объем стандартного раствора соли Мора, мл; V КТТ – объем титранта, затраченный на реакцию с ионами железа, мл. Результаты оформляют в виде таблицы 2.15.
Таблица 2.15 – Установление концентрации титранта КMnO4
3. Фотометрическое титрование раствора, содержащего ионы Fe2+ Раствор, полученный в мерной колбе вместимостью 100,0 мл, доводят до метки дистиллированной водой и перемешивают. Отбирают пипеткой 10,00 мл разбавленного раствора и переносят их в стакан для титрования. Прибавляют ~ 10 мл 2 М раствора H2SO4 и дистиллированную воду. Проводят фотометрическое титрование так же, как при установлении концентрации титранта КMnO4. Показания измерений V КMnO4 – I мкА записывают в виде таблицы 2.10. Проводят 3 – 4 параллельных титрований. Строят кривые титрования и определяют по ним V КТТ, как и при установлении концентрации титранта КMnO4. Содержание железа (ll) в растворе проводят по результатам каждого из параллельных титрований, используя формулу
где С (1/5КMnO4) – концентрация раствора КMnO4, моль/л; V КТТ – объем титранта, пошедший на реакцию с ионами железа, мл; V п – вместимость пипетки, мл; V к – вместимость мерной колбы, мл; M (Fe2+) – молярная масса железа, равная 55,85 г/моль. Результаты определения содержания железа (lll) в растворе представляют в виде таблицы 2.16.
Таблица 2.16 – Результаты определения Fe2+ в анализируемом растворе
4. Оценка воспроизводимости и правильности результатов анализа С целью оценки правильности и воспроизводимости результатов математическую обработку результатов анализа проводят в соответствии с рекомендациями [1, с.11]. Результаты расчета представляют в виде таблицы 2.14.
2.2.4. Контрольные вопросы 1. На чем основан метод фотометрического титрования? 2. От чего зависит форма кривой фотометрического титрования? 3. Какие требования предъявляют к реакциям, используемым в методе фотометрического титрования? 4. Нарисуйте схему установки для фотометрического титрования и укажите назначение ее отдельных узлов. 5. Как выбирают светофильтр? 6. Какие достоинства и недостатки имеет метод фотометрического титрования? 7. Какую форму имеет кривая титрования при реакции с окрашенным а) определяемым компонентом, б) продуктом реакции, в) титрантом? 8. Напишите реакции, которые лежат в основе фотометрического определения ионов кальция. 9. Что такое общая жесткость? 10. Какую форму имеет кривая фотометрического титрования раствора, содержащего соли жесткости, раствором ЭДТА в данной работе? Объясните характер кривой титрования. 11. Приведите условия, при которых возможно раздельно определить ионы кальция и магния при их совместном присутствии в растворе. 12. Напишите реакцию, которая лежит в основе фотометрического титрования ионов железа (ll). 13. Какую форму имеет кривая фотометрического титрования раствора, содержащего ионы Fe2+, раствором КMnO4 в данной работе? Объясните характер кривой титрования. 14. Благодаря чему происходит скачок титрования при фотометрическом определении а) ионов кальция или магния, б) железа (ll) в данной работе? 15. Объясните изменение окраски титруемого раствора в процессе титрования при определении а) ионов кальция или магния, б) железа (ll) в данной работе? 16. Что собой представляет ЭДТА? 17. Какие требования предъявляют к индикаторам, используемым при комплексонометрическом титровании? 18. Как готовят раствор титранта при определении кальция или магния? 19. Напишите реакцию, которая протекает при установлении концентрации титранта КMnO4 в данной работе.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 1399; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.175.114 (0.014 с.) |

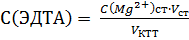 , моль/л,
, моль/л,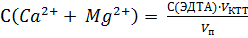 , моль/л.
, моль/л.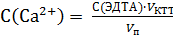 , моль/л.
, моль/л.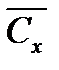
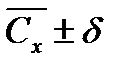
 , моль/л,
, моль/л,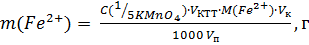 ,
,


