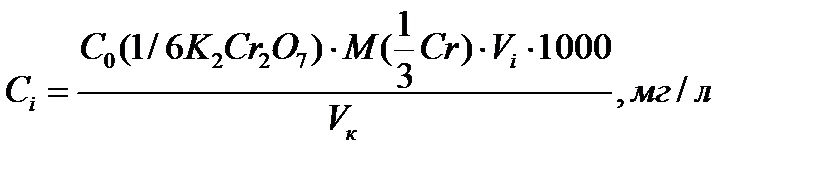Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гридина Н. Н. , новиков А. В. , баранов О. В. Министерство образования и науки Российской ФедерацииСодержание книги
Поиск на нашем сайте
МИНИСТЕРСТВО ОБРАЗОВАНИя И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМ. А.Н. КОСЫГИНА (ТЕХНОЛОГИИ. ДИЗАЙН. ИСКУССТВО)» (ФГБОУ ВО «РГУ им. А.Н. Косыгина»)
Гридина Н.Н., Новиков А.В., Баранов О.В.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. Часть 3. СПЕКТРАЛЬНЫЕ МЕТОДЫ АНАЛИЗА. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ Учебное пособие Допущено к изданию редакционно-издательским советом университета в качестве учебного пособия для подготовки бакалавров по направлению 18.03.01 Химическая технология, 29.03.03 Технология полиграфического и упаковочного производства, 20.03.01 Техносферная безопасность
Москва РГУ им. А.Н. Косыгина 2017 УДК 543.42(075) Г 83
Г 83 Гридина Н.Н., Новиков А.В., Баранов О.В. Физико-химические методы анализа. Часть 3. Спектральные методы анализа. Молекулярная спектроскопия: учебное пособие – М.:РГУ им. А.Н. Косыгина, 2017. – 76 с.
Рецензенты: – доцент кафедры аналитической химии Российского химико-технологического университета им. Д.И. Менделеева (РХТУ), к.х.н., доц. Ермоленко Ю.В. – профессор кафедры реставрации и химической обработки материалов ФГБОУ ВО «РГУ им. А.Н. Косыгина», д.т.н., Сафонов В.В.
В учебном пособии «ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. Часть 3. СПЕКТРАЛЬНЫЕ МЕТОДЫ АНАЛИЗА. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ» рассматриваются методы молекулярной спектроскопии. Разделы, посвященные лабораторным работам, содержат краткие теоретические основы методов, схемы установок и методики работы на них, а также методики выполнения количественных определений. Даны рекомендации по выполнению учебно-исследовательских заданий при прохождении лабораторного практикума, а также по статистической обработке и представлению полученных результатов. Учебное пособие предназначено для обучающихся по направлениям подготовки 18.03.01 Химическая технология, 29.03.03 Технология полиграфического и упаковочного производства и 20.03.01 Техносферная безопасность всех форм обучения при прохождении лабораторного практикума по дисциплине «Физико-химические методы анализа»
УДК 543.42(075)
Подготовлено к печати на кафедре химии и технологии полимерных материалов и нанокомпозитов
Печатается в авторской редакции.
СОДЕРЖАНИЕ
Введение. 5 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МОЛЕКУЛЯРНОЙ АБСОРБЦИОННОЙ СПЕКТРОСКОПИИ.. 6 2. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ В ВИДИМОЙ ОБЛАСТИ СПЕКТРА 10 2.1. Прямая фотометрия. 11 2.1.1. Установка для прямой фотометрии и методика измерения. 11 2.1.2. Исследование условий определения методом прямой фотометрии в видимой области спектра. 13 2.1.3. Определение компонентов технологических растворов, природных и сточных вод. 15 Порядок выполнения работ методом прямой фотометрии с использованием градуировочного графика. 15 Работа 1. Определение железа (lll) сульфосалициловой кислотой методом градуировочного графика. 18 Работа 2. Определение железа (lll) сульфосалициловой кислотой методом добавок 20 Работа 3. Определение железа (lll) роданидом калия. 23 Работа 4. Определение хрома (VI) дифенилкарбазидом. 24 Работа 5. Определение никеля (ll) диметилглиоксимом в присутствии окислителей 26 Работа 6. Определение цветности воды.. 27 Работа 7. Определение содержания красителя в ванне крашения. 29 Работа 8. Спектрофотометрический анализ двухкомпонентной смеси. 30 2.1.4. Контрольные вопросы.. 32 2.2. Фотометрическое титрование. 33 2.2.1. Установка для фотометрического титрования 34 2.2.2. Исследование условий определения методом фотометрического титрования 36 2.2.3. Определение компонентов технологических растворов, природных и сточных вод. 37 Работа 1. Определение ионов кальция и магния при совместном присутствии в растворе. 38 Работа 2. Определение ионов Fe2+ в растворе. 45 2.2.4. Контрольные вопросы.. 49 3. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ В УЛЬТРАФИОЛЕТОВОЙ ОБЛАСТИ СПЕКТРА.. 50 3.1. Установка для определений в УФ – области спектра. 50 3.2. Исследование условий определения в УФ–спектрометрии. 51 3.3. Определение органических веществ в технологических растворах и сточных водах 51 Работа 1. Определение концентрации поверхностно-активных веществ (ПАВ) в растворе. 52 Работа 2. Определение концентрации амидов карбоновых кислот в технологических растворах и сточных водах. 54 3.4. Контрольные вопросы.. 56 4. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ В ИНФРАКРАСНОЙ ОБЛАСТИ СПЕКТРА 57 4.1. Установка для определений в ИК–области спектра. 59 4.2. Подготовка образцов для регистрации спектров. Интерпретация ИК–спектров. 62 Работа. Идентификация волокон по функциональным группам. 63 4.3 Контрольные вопросы.. 71 Литература. 71 Приложение. 73
ВВЕДЕНИЕ
Настоящее пособие представляет лабораторный практикум по дисциплине «Физико-химические методы анализа». Физические и физико-химические методы анализа (ФХМА) широко используют в химико-аналитическом контроле технологических процессов и загрязнений окружающей среды. В пособие включены практические работы по методам молекулярной спектроскопии и рекомендации к их выполнению. В каждом разделе изложены краткие теоретические положения, приведены схемы установок и методики работы на них для получения результатов количественных определений, последовательность выполнения работ данным методом. Описание работ представлено таким образом, чтобы студент мог выполнить учебно-исследовательскую работу (УИР) по выбору условий определения компонентов в предложенном объекте исследования конкретным методом, составить методику определения, а также использовать предложенный метод для анализа других объектов. Составы объектов анализа (технологических растворов, сточных и природных вод), которые предлагаются для УИР, приведены в приложении пособия (таблица 1). Материал пособия позволяет студентам самостоятельно подготовиться к выполнению лабораторных работ, правильно оформить и представить результаты эксперимента. В конце каждого раздела приводятся контрольные вопросы для проверки своего уровня понимания и освоения изучаемого метода анализа и подготовки к защите лабораторных работ. При подготовке к выполнению практической работы студент самостоятельно в лабораторном журнале составляет конспект. Он включает название и цель работы, краткие теоретические основы метода, (на чем основан метод, какая измеряемая величина является аналитическим сигналом и как он связан с концентрацией определяемого компонента), уравнения протекающих химических реакций. Далее следует зарисовать схему установки и записать названия отдельных ее узлов, приборов, привести последовательность этапов выполнения работы. Методику измерений на приборе в журнал переписывать не следует. При выполнении работы все результаты измерений и расчетов концентраций записывают в подготовленные таблицы, указанные в пособии. Построение градуировочных графиков, кривых титрования выполняют на миллиметровой бумаге. Для каждого этапа работы записывают методику выполнения и формулы для расчетов. С целью оценки воспроизводимости и правильности результатов анализа каждая лабораторная работа заканчивается математической обработкой результатов определения. Материалы по статистической обработке результатов анализа даны в приложении пособия.
Прямая фотометрия
Методы прямой фотометрии основаны на непосредственном измерении оптической плотности раствора определяемого соединения при определенной длине волны и нахождении концентрации на основе закона Бугера-Ламберта-Бера. Для количественного определения применяют метод градуировочного графика, метод добавок и дифференциальный метод [1, с.6].
Выполнение работы Приготовление серии стандартных растворов F е(lll). В 5 мерных колб вместимостью 50,00 мл пипеткой переносят 1,00; 2,00; 3,00; 4,00; 5,00 мл основного стандартного раствора Fe (lll) с концентрацией С 0, ≈ 0,1000 мг/мл. В каждую колбу прибавляют по 1 мл 2 М раствора H2SO4 и по 10 мл 10%–го раствора сульфосалициловой кислоты. Содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрации приготовленных стандартных растворов. Растворы фотометрируют через 10 минут после их приготовления. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре описана в разделе 2.1.1. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, указанном в начале раздела 2.1.3. Определение ионов железа в анализируемом растворе. В мерную колбу вместимостью 50,00 мл помещают аликвоту анализируемого раствора V п, например 10,00 мл, прибавляют 1 мл 2 М раствора H2SO4 и 10 мл 10%–го раствора сульфосалициловой кислоты. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают. Через 10 минут измеряют оптическую плотность раствора при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы для получения градуировочного графика. Проводят от 4 до 6 параллельных определений. Содержание железа в фотометрируемом растворе находят по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание ионов железа в фотометрируемом растворе определяют по градуировочному графику. При расчете концентрации железа в анализируемом растворе учитывают его разбавление.
Порядок выполнения работы 1. Снятие спектра поглощения продуктов реакции при определении железа сульфосалициловой кислотой. Выбор длины волны λmax. 2. Приготовление стандартных растворов; построение градуировочного графика, установление линейной зависимости А = f (С). Выполнение пунктов 1 и 2 рассматривается выше в Работе 1. 3. Определение содержания ионов железа в анализируемом растворе методом добавок. В три мерные колбы вместимостью 50,00 мл помещают аликвотную часть анализируемого раствора V п, например 25,00 мл. 1-ю колбу оставляют без добавки, во 2-ю добавляют 1,00 мл, а в 3-ю – 2,00 мл стандартного раствора Fe(lll) с концентрацией С ст, ≈ 0,1000 мг/мл. В каждую колбу прибавляют по 1 мл 2 М раствора H2SO4 и по 10 мл 10%–го раствора сульфосалициловой кислоты. Содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Вычисляют концентрацию добавки стандартного раствора железа по формуле
где C ст – концентрация стандартного раствора Fe(lll) для добавки, V ст и V к – объем добавки стандартного раствора и объем колбы, соответственно. Оптическую плотность приготовленных растворов измеряют на спектрофотометре, установив предварительно выбранную длину волны в кювете толщиной 1 или 2 см. Измерения проводят через 10 минут после приготовления. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре приводится в разделе 2.1.1. Результаты измерений методом добавок записывают в таблицу 2.5.
Таблица 2.5 – Результаты определения Fe(lll) методом добавок (C ст = ….мг/мл, V к = ….мл, V п = ….мл)
По полученным результатам строят график в координатах А = (С Fe3+) и находят С х, т.е. концентрацию ионов железа в фотометрируемом растворе.
Рисунок 2.3 – Графическое определение концентрации методом добавок
Концентрацию ионов железа(lll) в исходном растворе рассчитывают с учетом разбавления:
Выполнение работы
Приготовление стандартных растворов Fe (lll). В мерные колбы вместимостью 50,0 мл пипеткой вносят 2,00; 4,00; 6,00; 8,00; 10,00 мл основного стандартного раствора Fe(lll) с концентрацией С 0, ≈ 0,01000 мг/мл. В каждую колбу прибавляют 1 мл 2 М раствора H2SO4 и 5 мл 1 М раствора KSCN. Содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрации приготовленных стандартных растворов. Измерения оптической плотности растворов проводят через 5 минут после их приготовления. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре описана в разделе 2.1.1. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, указанном в начале раздела 2.1.3. Определение ионов железа в анализируемом растворе. В мерную колбу вместимостью 50,00 мл помещают аликвоту анализируемого раствора, прибавляют 1 мл 2 М раствора H2SO4 и 5 мл 1 М раствора KSCN. Содержимое колбы доводят до метки дистиллированной водой и тщательно перемешивают. Через 5 минут измеряют оптическую плотность раствора при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы для получения градуировочного графика. Проводят от 4 до 6 параллельных определений. Содержание ионов железа в фотометрируемом растворе находят по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание ионов железа определяют по градуировочному графику. При расчете концентрации железа в анализируемом растворе учитывают его разбавление. Выполнение работы
Приготовление стандартных растворов K 2 Cr 2 O 7. Стандартные растворы дихромата калия используют для построения градуировочного графика. 1. Рабочий раствор дихромата калия с С (1/6K2Cr2O7) = 0,01000 моль/л (раствор №1) готовят разбавлением стандартного 0,1000 М раствора K2Cr2O7 в 10 раз. Для этого в мерную колбу вместимостью 100,0 мл пипеткой переносят 10,00 мл раствора С (1/6K2Cr2O7) = 0,1000 моль/л и доводят объем раствора до метки дистиллированной водой. 2. Рабочий раствор дихромата калия с С (1/6K2Cr2O7) = 0,5 . 10–3 моль/л (раствор №2) готовят разбавлением раствора №1 в 20 раз в мерной колбе вместимостью 100,0 мл. В 1мл полученного раствора содержится 8,66 мг Cr6+. 3. Приготовление серии стандартных растворов Cr(VI). В 5 мерных колб вместимостью 50,00 мл пипеткой переносят 1,00; 2,00; 3,00; 4,00; 5,00 мл стандартного раствора № 2 с С (1/6K2Cr2O7) = 0,5 . 10–3 моль/л. В каждую колбу прибавляют 1 мл 1 М раствора H2SO4, 1 мл раствора дифенилкарбазида, доводят до метки дистиллированной водой и перемешивают. Рассчитывают концентрацию Cr(VI) в каждой колбе по формуле
где С 0(1/6K2Cr2O7) – концентрация стандартного раствора дихромата калия (раствор №2), моль/л; Vi – объем стандартного раствора K2Cr2O7, мл; V к – вместимость мерной колбы, мл. Одновременно готовят раствор сравнения (холостая проба). В мерную колбу вместимостью 50,00 мл прибавляют 1 мл 1 М раствора H2SO4, 1 мл раствора дифенилкарбазида, доводят до метки водой и перемешивают. Через 10 минут после приготовления измеряют оптическую плотность стандартных растворов относительно раствора сравнения. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, указанном в начале раздела 2.1.3. Определение концентрации хрома (VI) в анализируемой воде. Для определения Cr(VI) в анализируемом растворе аликвоту этого раствора помещают в мерную колбу вместимостью 50,0 мл, прибавляют 1 мл 1М раствора H2SO4, 1 мл дифенилкарбазида, доводят до метки водой, перемешивают. Через 10 минут измеряют оптическую плотность раствора относительно раствора сравнения. Измерения проводят при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы. Проводят от 4 до 6 параллельных определений для последующей оценки воспроизводимости и правильности результатов. Содержание ионов Cr(VI) в фотометрируемом растворе находят по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание ионов хрома (VI) определяют по графику. При расчете концентрации в анализируемом растворе учитывают его разбавление.
Выполнение работы Приготовление серии стандартных растворов Ni (ll). В пять мерных колб вместимостью 50,0 мл наливают по 20 мл воды, пипеткой вносят 2,00; 4,00; 6,00; 8,00; 10,00 мл основного стандартного раствора Ni(ll) с концентрацией С 0, ≈ 0,01000 мг/мл. В каждую колбу прибавляют 1 мл раствора J2 и 1 мл раствора диметилглиоксима. Через 5 минут содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрации приготовленных стандартных растворов. Измерения оптической плотности растворов проводят через 10 минут после их приготовления. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре описана в разделе 2.1.1. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, указанном в начале раздела 2.1.3. Для определения ионов никеля (ll) в анализируемом растворе в мерную колбу вместимостью 50,0 мл помещают аликвоту анализируемого раствора, прибавляют 20 мл дистиллированной воды, 1 мл раствора J2 и 1 мл раствора диметилглиоксима. Через 5 минут содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Через 10 минут измеряют оптическую плотность раствора при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы. Проводят от 4 до 6 параллельных определений. Содержание ионов никеля в фотометрируемом растворе находят по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание ионов Ni(ll) определяют по градуировочному графику. При расчете концентрации Ni(ll) в анализируемом растворе учитывают его разбавление.
Выполнение работы Приготовление шкалы цветности. Для приготовления шкалы цветности готовят два раствора: основной стандартный раствор (№ 1) и раствор для разбавления (№ 2). Раствор № 1 получают растворением отдельно в дистиллированной воде 0,0875 г K2Cr2O7 и 2,000 г CoSO4 . 7Н2О. Оба раствора смешивают в мерной колбе вместимостью 1 л, добавляют 1,00 мл концентрированной (95 %-ой) серной кислоты и доводят объем до метки дистиллированной водой. Этот раствор отвечает цветности 500о. Раствор № 2 готовят разбавлением в мерной колбе вместимостью 1 л 1,00 мл концентрированной серной кислоты. Растворы шкалы цветности получают смешиванием растворов №№ 1 и 2 в соотношениях, приведенных в таблице 2.6.
Таблица 2.6 – Приготовление растворов шкалы цветности
Для приготовления растворов шкалы цветности в мерные колбы вместимостью 100,0 мл пипеткой или бюреткой отбирают 1,00, 2,00, 3,00 и т.д. миллилитров раствора № 1 и доводят до метки раствором № 2. Определение цветности воды проводят в соответствии с задачами исследования (раздел 2.1.2) и порядком выполнения работ, приведенном в начале раздела 2.1.3. Снимают спектр поглощения А = f (λ) для одного из приготовленных стандартных растворов шкалы цветности и выбирают длину волны (см. раздел 2.1.2). Для построения градуировочной зависимости измеряют оптическую плотность стандартных растворов шкалы цветности при выбранной длине волны относительно дистиллированной воды. Строят градуировочный график в координатах «оптическая плотность – градусы цветности» и для линейной части графика рассчитывают уравнение регрессии. Измеряют 4 – 6 раз оптическую плотность анализируемой воды при λ max относительно дистиллированной воды. Цветность рассчитывают по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности цветность анализируемой воды определяют по градуировочному графику. Выполнение работы
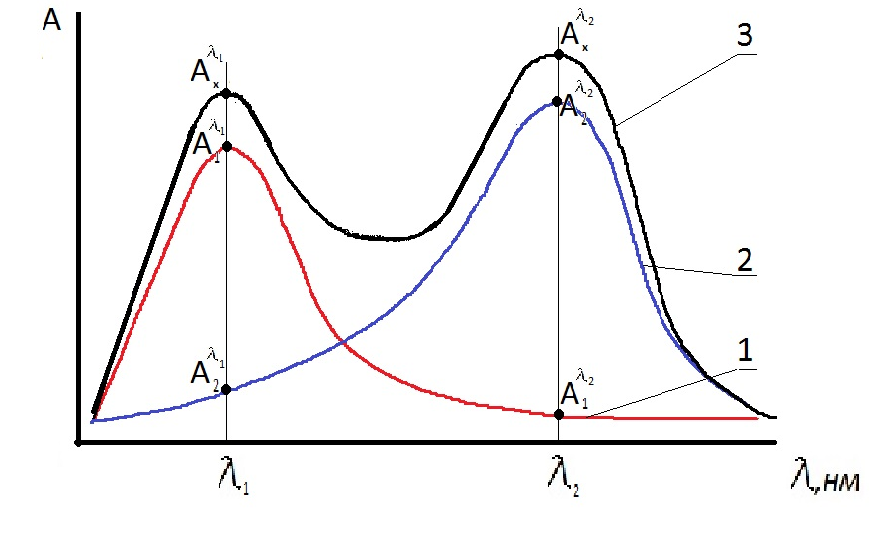
Приготовление серии стандартных растворов красителя. В мерные колбы вместимостью 50,0 мл пипеткой помещают соответственно 1,00; 2,00; 3,00; 4,00; 5,00 мл основного стандартного раствора красителя и доводят до метки дистиллированной водой. Раствор тщательно перемешивают. Рассчитывают концентрации приготовленных стандартных растворов красителя, г/л. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре описана в разделе 2.1.1. Все последующие этапы работы (выбор длины волны, толщины кюветы, построение градуировочного графика, проверка его стабильности во времени) проводят в соответствии с задачами исследования (раздел 4.1.2) и порядком выполнения работ, приведенном в начале раздела 2.1.3. Определение концентрации красителя в ванне крашения. Аликвотную часть анализируемого раствора помещают в колбу вместимостью 50,00 мл, доводят до метки дистиллированной водой и перемешивают. Измеряют оптическую плотность раствора при тех же условиях (длина волны, толщина кюветы, раствор сравнения), при которых фотометрировали стандартные растворы для получения градуировочного графика. Проводят от 4 до 6 параллельных определений для последующей оценки воспроизводимости и правильности результатов. Содержание красителя в фотометрируемом растворе рассчитывают по уравнению градуировочного графика. Для одного из параллельных измерений оптической плотности содержание красителя определяют по градуировочному графику. При расчете концентрации в анализируемом растворе учитывают его разбавление. Выполнение работы 1. Приготовление стандартных растворов двух красителей с концентрацией C 1o и C 2o. В мерных колбах V к = 50,00 мл разбавляют раствор каждого красителя с концентрациями C 1 и C 2 в 20 раз. 2. Измеряют оптическую плотность приготовленных стандартных растворов и анализируемого раствора, т.е раствора смеси красителей, в диапазоне длин волн 400 - 680 нм с шагом ∆ λ = 10 нм. Результаты заносят в таблицу 2.7. На одном графике строят три спектра поглощения А = f (λ): стандартных растворов красителей и анализируемого раствора смеси красителей. 3. На спектрах для 1 и 2-го красителя находят λ max (длину волны, которой соответствует наибольшая величина оптической плотности). Измеряют оптические плотности стандартных растворов красителей и анализируемого раствора при λ 1 – А 1 λ 1, А 2 λ 1, А x λ 1 и при λ 2 – А 1 λ 2; А 2 λ 2 А x λ 2. Данные вносят в таблицу 2.8. 4. Рассчитывают концентрации каждого красителя в смеси по формулам (4) и (5).
Рисунок 2.3 – Спектры поглощения растворов красителей (1), (2) и их смеси (3)
Таблица 2.7 – Светопоглощение растворов красителей
Таблица 2.8 – Данные для определения состава смеси
2.1.4. Контрольные вопросы 1. На чем основан метод спектрофотометрии в видимой области спектра? 2. Каким энергетические переходы происходят при поглощении излучения видимой области молекулами определяемого соединения? 3. Перечислите основные параметры электромагнитного излучения. 4. Напишите уравнение Планка для характеристики электромагнитного излучения. 5. Что такое спектр поглощения? Как его изображают графически в видимой области? 6. С какой целью снимают спектр анализируемого соединения? 7. Нарисуйте блок-схему спектрофотометра, назовите основные узлы прибора и их назначение. 8. Какие характеристики используют для оценки степени поглощения раствором определяемого вещества видимого излучения? 9. Сформулируйте основной закон светопоглощения. Запишите его выражение. Как его используют в фотометрии? 10. Что представляет собой молярный коэффициент поглощения ε и что он характеризует? Как можно определить ε? 11. С какой целью снимают градуировочный график А = f (С)? 12.Приведите последовательность проведения анализа прямым фотометрическим методом. 13. Какие факторы влияют на выбор толщины кюветы? 14. Что такое раствор сравнения и для чего его применяют? 15. Назовите условия проведения анализа методом прямой фотометрии в видимой области спектра. 16. Толщина поглощающего слоя раствора увеличена в три раза. Как изменится оптическая плотность раствора? 17. Концентрация раствора увеличена в 2 раза. Как изменится оптическая плотность раствора? 18. Рассчитайте молярный коэффициент поглощения, если при измерениях использовали кювету толщиной 5 см, измеренная оптическая плотность раствора красителя равна 0,490, концентрация красителя – 2.10–4 М. 19. В каком случае разбавляют анализируемый раствор? Как подбирают и проводят разбавление? 20. Как оценить воспроизводимость и правильность результатов определения? Фотометрическое титрование Метод фотометрического титрования основан на последовательном измерении поглощения раствора в процессе титрования и установлении зависимости между оптической плотностью раствора А (или пропусканием Т) и объемом прибавленного титранта. Фотометрическое титрование проводят при определенной длине волны, которую выбирают по предварительно снятым спектрам поглощения исходного раствора и раствора с избытком титранта. Излучение, поглощаемое раствором, должно подчиняться закону Бугера-Ламберта-Бера. В этом случае наблюдается прямолинейная зависимость между оптической плотностью титруемого раствора и объемом титранта. Объем титранта в конечной точке титрования V ктт находят по кривой титрования как точку пересечения ее линейных участков. Концентрацию определяемого соединения, зная V ктт, рассчитывают на основании закона эквивалентности. Фотометрическое титрование обычно используют при поглощении веществом излучения в видимой области спектра. Необходимо, чтобы один из компонентов реакции – определяемое вещество, титрант или продукт реакции – имел характерную полосу поглощения, т.е. был окрашен (безинди каторное титрование). Если ни один из участников реакции не поглощает излучение, то можно проводить титрование с индикатором. В качестве индикатора в титруемую систему вводят новое вещество, которое образует окрашенное соединение с одним из компонентов реакции. Основным условием выполнения определения методом фотометрического титрования является резкое изменение оптической плотности титруемого соединения в точке эквивалентности. Метод фотометрического титрования имеет ряд преимуществ перед визуальным методом индикации КТТ. Он отличается большей чувствительностью, правильностью, избирательностью, дает возможность автоматизировать процесс титрования.
Порядок выполнения работ
1. Выбор светофильтра. 2. Приготовление растворов титранта и установочного вещества. 3. Установление концентрации титранта. 4. Определение содержания определяемого компонента в анализируемом растворе. 5. Математическая обработка результатов определения. Оценка воспроизводимости и правильности полученных результатов анализа. Выполнение работы Определение суммарного содержания Ca 2+ и Mg 2+ (общей жесткости) 1. Выбор светофильтра для титрования суммы ионов Ca 2+ и Mg 2+ Приготовьте в стаканах для титрования два раствора: № 1 – к 10-20 мл раствора соли Mg2+, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачной буферной смеси и дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Розовая окраска раствора обусловлена образования комплекса МеInd3-. № 2 – к 10-20 мл раствора соли Mg2+, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачной буферной смеси и избыток раствора ЭДТА до появления голубой (синей) окраски. Доливают дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Далее проводят измерения интенсивности поглощения на титраторе Т-107 в следующем порядке: – устанавливают «0» по воздуху при закрытой шторке (корректор помещают слепым концом вниз); – шторку открывают, переворачивая корректор прорезью вниз, и по воздуху устанавливают значение микроамперметра в диапазоне «80 – 90» барабаном (раздвижной шторкой грубой регулировки); – устанавливают светофильтр № 1; – в кюветное отделение поочередно устанавливают стаканы с растворами № 1 и № 2 и записывают соответствующие показания фототока; – эти операции выполняют последовательно со всеми светофильтрами №№ 2–5. Показания измерений записывают в таблицу 2.9.
Таблица 2.9 – Выбор светофильтра для фотометрического титрования
Результаты измерений наносят на один график в координатах «пропускание – длина волны (№ светофильтра) и по спектрам выбирают тот светофильтр, которому соответствует максимальная разность величин пропускания (показания фототока). Пример спектров поглощения приведен на рисунке 2.6.
2. Приготовление титранта Титрант готовят разбавлением более концентрированного раствора. Рассчитывают, какой объем стандартного ~ 0,1 М раствора ЭДТА V 1, необходимо для приготовления 250 мл 0,005 М раствора ЭДТА, используя выражение C 1 V 1 = C 2 V 2,
Полученное значение объема округляют до целого количества мл. Необходимый объем раствора пипеткой переносят в колбу, доводят до метки дистиллированной водой и тщательно перемешивают. 3. Приготовление стандартного раствора магния Стандартный раствор магния используют для стандартизации приготовленного раствора ЭДТА. Стандартный раствор магния концентрации ~ 0,005000 моль/л готовят путем разбавления более концентрированного исходного стандартного ~ 0,1 М раствора в мерной колбе вместимостью 100,0 мл. Предварительно рассчитывают объем исходного раствора V 1, который необходим для приготовления. Полученное значение объема округляют до целого количества мл. Необходимый объем раствора пипеткой переносят в мерную колбу, доводят до метки дистиллированной водой и тщательно перемешивают. Рассчитывают концентрацию приготовленного стандартного раствора магния с точностью до 4–х значащих цифр.
4. Установление концентрации титранта ЭДТА Раствор титранта заливают бюретку. В стакан для титрования пипеткой отбирают 10,00 мл приготовленного стандартного раствора магния, прибавляют 1-2 капли раствора индикатора кислотного хром синего К, ~ 10 мл аммиачного буферного раствора и дистиллированную воду до такого объема, чтобы при помещении стакана в кюветный блок световой поток проходил через раствор. Проводят титрование раствором ЭДТА согласно методике измерений, описанной выше (см. раздел. 2.2.1), установив выбранный светофильтр. Титрант прибавляют по 0,5 мл, записывая каждый раз значение фототока в таблицу 2.10. После резкого скачкообразного изменения фототока выполняют еще 4 – 5 измерений. Титрование стандартного раствора Mg2+ повторяют 3 раза. По результатам каждого титрования строят кривую титрования на миллиметровой бумаге в координатах I = f (V титранта) в масштабе: по оси абсцисс 2 см – 1 мл, а по оси ординат 2 см – 10 или 20 мкА. Определяют объем титранта в КТТ, как указано на рисунке 2.7. Кривые строят на одном листе, сдвигая их начало по оси абсцисс на 2 см.
Таблица 2.10 – Результаты титрования стандартного раствора Mg2+
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 156; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.50.1 (0.064 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

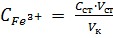 ,
,
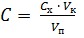 .
.