
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 2. Определение железа (lll) сульфосалициловой кислотой методом добавокСодержание книги
Поиск на нашем сайте
Метод добавок является разновидностью метода сравнения и используется после установления линейной зависимости А = f (C). Определение концентрации вещества по этому методу основано на сравнении оптической плотности анализируемого раствора и того же раствора с добавкой определенного объема стандартного раствора определяемого компонента [1]. Концентрацию и объем раствора добавки подбирают экспериментальным путем таким образом, чтобы оптическая плотность раствора с добавкой увеличилась приблизительно в два раза. Неизвестную концентрацию определяемого компонента находят графическим или расчетным способом. Из основного закона светопоглощения следует:
A х = ε . l . C х и А х + доб = ε . l . (C х + Сдоб),
где С х – концентрация компонента в анализируемом растворе; Сдоб – концентрация добавки стандартного раствора в анализируемом растворе; А х – оптическая плотность анализируемого раствора; А х + доб – оптическая плотность анализируемого раствора с добавкой. Решение системы этих уравнений относительно С х дает следующую формулу для расчета концентрации определяемого компонента в анализируемом растворе:
Концентрацию добавки стандартного раствора, учитывая способ приготовления растворов для фотометрирования в данной работе, можно выразить следующим образом
где C ст – концентрация стандартного раствора для добавки; V доб – объем добавки стандартного раствора. V к – объем колб, в которых готовят растворы для фотометрирования.
Для графической обработки результатов анализа (см. рисунок 2.3) на оси абсцисс откладывают концентрацию добавки стандартного раствора, по оси ординат – соответствующие величины оптической плотности растворов. За нуль принимают концентрацию анализируемого раствора без добавки. Через точки А х, А х+1и А х+2 проводят прямую линию до пересечения с осью абсцисс. При равенстве разбавления растворов величина отрезка, отсекаемого этой прямой слева от нуля на оси абсцисс, равна концентрации анализируемого раствора С х. В настоящей работе фотометрическое определение ионов железа проводят в виде моносульфосалицилового комплекса (см. Работа 1).
Цель работы: Фотометрическое определение содержания ионов Fe(lll) в водах методом добавок расчетным и графическим способом.
Реактивы, посуда, приборы Стандартный раствор Fe (lll), C ст = 0,1 мг/мл. Сульфосалициловая кислота, 10 %-й раствор. Раствор серной кислоты, С (1/2H2SO4) = 2 моль/л. Мерные колбы вместимостью 50,00 мл – 3 шт. Пипетка с делениями на 2,00 мл. Спектрофотометр. Кюветы l = 1или 2см. Порядок выполнения работы 1. Снятие спектра поглощения продуктов реакции при определении железа сульфосалициловой кислотой. Выбор длины волны λmax. 2. Приготовление стандартных растворов; построение градуировочного графика, установление линейной зависимости А = f (С). Выполнение пунктов 1 и 2 рассматривается выше в Работе 1. 3. Определение содержания ионов железа в анализируемом растворе методом добавок. В три мерные колбы вместимостью 50,00 мл помещают аликвотную часть анализируемого раствора V п, например 25,00 мл. 1-ю колбу оставляют без добавки, во 2-ю добавляют 1,00 мл, а в 3-ю – 2,00 мл стандартного раствора Fe(lll) с концентрацией С ст, ≈ 0,1000 мг/мл. В каждую колбу прибавляют по 1 мл 2 М раствора H2SO4 и по 10 мл 10%–го раствора сульфосалициловой кислоты. Содержимое колб доводят до метки дистиллированной водой и тщательно перемешивают. Вычисляют концентрацию добавки стандартного раствора железа по формуле
где C ст – концентрация стандартного раствора Fe(lll) для добавки, V ст и V к – объем добавки стандартного раствора и объем колбы, соответственно. Оптическую плотность приготовленных растворов измеряют на спектрофотометре, установив предварительно выбранную длину волны в кювете толщиной 1 или 2 см. Измерения проводят через 10 минут после приготовления. В качестве раствора сравнения используют дистиллированную воду. Методика измерения оптической плотности на спектрофотометре приводится в разделе 2.1.1. Результаты измерений методом добавок записывают в таблицу 2.5.
Таблица 2.5 – Результаты определения Fe(lll) методом добавок (C ст = ….мг/мл, V к = ….мл, V п = ….мл)
По полученным результатам строят график в координатах А = (С Fe3+) и находят С х, т.е. концентрацию ионов железа в фотометрируемом растворе.
Рисунок 2.3 – Графическое определение концентрации методом добавок
Концентрацию ионов железа(lll) в исходном растворе рассчитывают с учетом разбавления:
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 719; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.150.130 (0.009 с.) |

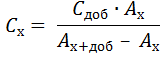
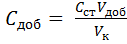 ,
,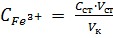 ,
,
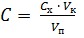 .
.


