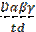Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение активности пероксидазыСодержание книги
Поиск на нашем сайте
Пероксидазы (КФ 1.11.1.7) - ферменты, окисляющие субстрат при помощи пероксида водорода. Общий вид реакции
Н2О2 + АН2 → А + 2Н2О,
где А и АН2 — окисленный и восстановленный субстраты, соответственно.
Субстратами пероксидаз служат фенолы и ароматические соединения, органические гидроперекиси с небольшими алифатическими заместителями, НАДН (НАДФН), нафтогидрохинон, индолилуксусная кислота и др. Пероксидазы - железосодержащие ферменты, простетической группой которых является гем — феррипротопорфирин IX. Окисление субстратов осуществляется, по одноэлектронному механизму. Первой стадией каталитического процесса является образование комплекса между железом фермента и пероксидом водорода. Следовательно, окисление субстрата осуществляется пероксидом водорода, активированным ферментом:
Соединение 1 — окисленная форма фермента, где железо связано с пероксидом и валентное состояние Fe выше Fe3+; соединение 2 — продукт восстановления соединения 1 путем одноэлектронного восстановления за счет субстрата АН2; АН2 — субстрат реакции; АН∙ — свободнорадикальная форма окисленного субстрата; А — продукт полного окисления субстрата.
В растительных тканях пероксидазы широко распространены: в основном их находят в пероксисомах, обнаружены они также в клеточной стенке. Известно более 20 изоформ пероксидазы с различной каталитической активностью. Множественность форм фермента и каталитических функций позволяет судить о значительной роли пероксидаз в биохимии и физиологии растений, однако до сих пор их физиологическое значение окончательно не выяснено. Показано изменение изоферментного состава пероксидаз и их активности в онтогенезе растений, при патогенезе, в условиях стресса. Активность пероксидаз наряду с каталазой, очевидно, препятствует накоплению пероксида водорода в клетке. Используя для окисления пероксид водорода, пероксидазы могут играть важную роль в нейтрализации продуктов вторичного обмена (фенолов), в регуляции гормонального статуса растений через окисление индолилуксусной кислоты, образование этилена из метионина, участвуют в процессах синтеза лигнина в клеточной стенке. Однако одноэлектронный механизм переноса, который осуществляется пероксидазой при окислении субстрата, может привести к образованию активированных форм кислорода (О2 и др.), вызывающих повреждающий эффект в клетке. Тем не менее, образованные в пероксидазных реакциях активные формы кислорода могут быть использованы растением в защите от патогенов. Определение активности пероксидазы, основано на образовании окрашенных продуктов при окислении бензидина, гваякола, гидрохинона, катехола и других фенолов. Общая схема реакции:
В данной работе используется наиболее чувствительный и быстрый гваяколовый метод. При действии пероксидаз в присутствии пероксида водорода гваякол окисляется до тетрагвая - кохинона, что приводит к развитию красно-коричневой окраски в реакционной среде и позволяет провести фотометрическое измерение скорости ее образования.
Цель работы. Определение активности пероксидазы в различных органах растения, изменение активности фермента с возрастом растения. Объект исследования. Листья и корни проростков гороха разного возраста. Реактивы и оборудование: 1/15 М фосфатный буфер, pH 6,5 - 6,7; 0,1 %-й раствор Н2О2; раствор гваякола (0,183 г в 50 мл воды); фарфоровые ступки с пестиками; мерные колбы объемом 50 мл; стеклянные стаканы объемом 100 мл; средние стеклянные воронки; пипетки объемом 2 и 5 мл; автоматические пипетки; бумажные фильтры; ФЭК; стеклянные кюветы к ФЭКу толщиной 2 см.
Порядок работы. 1. Навеску растительного материала (50 - 100 мг) растереть в ступке в 5 мл фосфатного буфера. 2. Растертую массу перенести количественно в мерную пробирку, довести пробу буфером до метки 10 мл, перемешать, поместить в холодильник (4°С) на 10 - 15 мин. 3. Центрифугировать 10 мин при 4000 об/мин. Использовать супернатант для определения активности фермента. 4. Исследовать активность фермента на ФЭКе (λ=440 нм) по времени развития окраски до определенного значения оптической плотности (значение D выбрать в зависимости от скорости развития окраски в пределах от 0,25 до 0,4). 5. Для анализа каждой биологической пробы использовать три одинаковые кюветы ФЭКа: одна - контрольная, две другие - опытные (две аналитические повторности из одной биологической пробы). 6. Во все три кюветы внести: 2 мл вытяжки; 2 мл буферного раствора, 2 мл гваякола. 7. В контрольную кювету прилить 2 мл воды и установить ее в контрольную (дальнюю) кюветную подставку ФЭКа. Ввести кювету в световой луч. 8. Закрыть кюветную камеру, установить нуль на шкале оптической плотности по контрольному образцу. 9. Одну из опытных кювет поставить в держатель и ввести в световой луч. 10. Автоматической пипеткой внести в опытную кювету 2 мл раствора Н2O2 и одновременно включить секундомер. 11. Закрыть кюветную камеру и по шкале оптической плотности следить за развитием окраски. 12. По секундомеру отметить время достижения необходимой оптической плотности. 13. Аналогично провести измерение для второй опытной кюветы. 14. Провести расчет активности по формуле
А= где А - активность, выраженная в относительных единицах на 1 г сырой массы за 1 с; D - зарегистрированная в опыте оптическая плотность; t - время, с; d - толщина слоя жидкости (толщина кюветы), см; α, β, γ - факторы разведения: α - отношение количества жидкости, взятой для приготовления вытяжки, мл, к массе навески, г; β - степень дополнительного разведения вытяжки после центрифугирования (если это требовалось); γ - степень постоянного разведения вытяжки в кювете (в данной работе равна 4). 15. Представить результаты в виде таблицы (составить самостоятельно). 16. Сделать выводы о зависимости активности фермента от исследуемых физиологических факторов.
Раздел 4. Водный обмен
Все физиологические процессы в растении нормально протекают лишь, при оптимальном его обеспечении водой. Вода - не только растворитель, но и активный структурный компонент клетки. Она участвует в биологических превращениях, например, облегчает взаимодействие между молекулами, служит субстратом для фотосинтеза, участвует в дыхании и многочисленных гидролитических и синтетических процессах. Вода обладает очень высокой теплоемкостью, поэтому способствует стабилизации температуры растения. Пронизывая все органы, она создает в растении непрерывную фазу, обеспечивая связь органов друг с другом, а также возможность передвижения по растению питательных веществ. Вода играет существенную роль в сохранении формы травянистых растений, поддерживая их клетки в состоянии тургора. Водный баланс растения определяется соотношением между поглощением и выделением воды. Для сведения водного баланса без дефицита необходимо, чтобы расходование влаги листьями компенсировалось ее поглощением через корни. Подвядание растений приводит к серьезным нарушениям в ультраструктуре клеток и обмене веществ. Даже кратковременный недостаток влаги не проходит для растения бесследно. После установления оптимальных условий водоснабжения фотосинтез восстанавливается лишь через пять - семь дней, рост - через две - три недели, что приводит к значительной потере урожая. Вода поступает в растение в результате корневого давления и присасывающего действия транспирации. Деятельность нижнего концевого двигателя, состоящая в активном поглощении воды корневой системой, проявляется в плаче и гуттации растений. Силу, поднимающую воду вверх по сосудам, называют корневым давлением. Величина его обычно составляет 50 - 150 кПа. Корневое давление имеет большое значение в поглощении воды растением при подземном прорастании и в весеннее время до распускания листьев. Существенна роль корневого давления в поддержании непрерывности водных нитей в сосудах ксилемы. Корневое давление ликвидирует в ночные часы возникший за день водный дефицит. Работа верхнего концевого двигателя обусловлена испарением воды с поверхности листа (транспирацией). Присасывающее действие транспирации передается корням в форме гидродинамического натяжения, связывающего работу обоих двигателей. Работа верхнего концевого двигателя, основанная па использовании в качестве источника энергии солнечной радиации, регулируется автоматически (усиление потери влаги снижает водный потенциал испаряющих клеток, что ведет к усилению поступления в них воды). У хорошо облиственных растений присасывающая сила транспирации во много раз превосходит силу корневого давления. Основную роль в испарении воды растениями играют устьица. Поэтому интенсивность транспирации в значительной степени зависит от степени их открытости. Кроме того, растение может уменьшать транспирацию, снижая испарение воды с поверхности клеток в межклетники за счет возрастания водоудерживающей способности протоплазмы и клеточных стенок.
Работа 15
|
||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 535; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |

 Фенол + Н2О2 Хинон + 2Н2О
Фенол + Н2О2 Хинон + 2Н2О