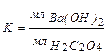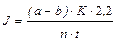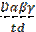Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 1. Физиология растительной клеткиСтр 1 из 19Следующая ⇒
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ФИЗИОЛОГИЯ РАСТЕНИЙ Методические указания К практическим занятиям Уфа РИЦ БашГУ 2014 Печатается по решению кафедры биохимии и биотехнологии БашГУ (протокол №1 от 29.08.2014)
Составитель: канд. биол. наук, доцент – В.В. Федяев
Методические указания «Молекулярная биология растений» предназначены для подготовки и проведения практических занятий по дисциплине «Молекулярная биология растений» для студентов 3 курса биологического факультета по направлению 240700 - «Биотехнология»
Лицензия на издательскую деятельность ЛР №021319 от 05.01.99 г. Подписано к печати 16.09.2014 г. Формат 60х84/16. Тираж 50 экз. Заказ 396.
Редакционно-издательский центр Башкирского государственного университета 450076, РБ, г. Уфа, ул. Заки Валиди, 32 Отпечатано на множительном участке Башкирского государственного университета 450076, РБ, г. Уфа, ул. Заки Валиди, 32
Раздел 1. Физиология растительной клетки Клетка как осмотическая система. Плазмолиз Поглощение воды является важнейшим условием существования клетки. Сформировавшаяся клетка растения имеет большую вакуоль с водным раствором органических и минеральных веществ. Концентрация этих веществ в клеточном соке и степень их диссоциации определяют потенциальное осмотическое давление клетки – её способность всасывать воду. Вода поступает в клетку извне в результате разности химических потенциалов воды в клетке и окружающем растворе. Разность химического потенциала воды в клетке (m w) и химического потенциала чистой воды (m 0 w), отнесенную к парциальному объёму воды в клетке (V w), называют водным потенциалом (y w):
Химический потенциал чистой воды всегда выше химического потенциала воды в составе вакуолярного раствора клетки, поэтому значение водного потенциала раствора всегда имеет отрицательное значение. По величине водного потенциала определяют сосущую силу клетки, т.е. её способность поглощать воду. Сосущая сила клетки меняется в зависимости от степени насыщения клетки водой – её тургора. Наибольшей сосущей силой клетка обладает при полном отсутствии тургора. В этом момент способность к поглощению воды клеткой определяется потенциальным осмотическим давлением. Тургорное давление – это сила, с которой содержимое клетки (протопласт), насыщенное водой давит на клеточную стенку. В состоянии полного насыщения клетки водой тургорное давление полностью уравновешивает осмотическое, и клетка перестаёт поглощать воду. Водный потенциал в этот момент равен нулю.
Работа 1 Порядок работы 1. На выпуклой поверхности чешуи луковицы лезвием сделать надрез и аккуратно снять кусочек эпидермиса. 2. Полученный фрагмент ткани поместить на предметное стекло в каплю воды. 3. Препарат накрыть покровным стеклом и рассмотреть в микроскоп при малом увеличении. 4. С одной стороны покровного стекла, не сдвигая препарата, кусочком фильтровальной бумаги удалить воду и внести раствор соли. 5. Определить время плазмолизапри воздействии растворов различных солей. 6. Зарисовать разные формы плазмолиза. 7. Результаты опыта записать по форме (Табл. 1). Таблица 1. Влияние анионов и катионов солей на время плазмолиза
8. Сделать вывод о влиянии различных катионов и анионов на вязкость цитоплазмы
Работа 2 Порядок работы. 1. Приготовить препарат эпидермиса выпуклой стороны чешуи лука, содержащего антоциан. 2. Погрузить препарат в раствор азотнокислого калия (1 М) 3. Оставить препарат в растворе на 30 мин - 1 час. 4. Рассмотреть под микроскопом, отмечая образование колпачкового плазмолиза. 5. Провести параллельный опыт с нитратом кальция (1 М). 6. Зарисовать одну клетку с хорошо выраженным колпачковым плазмолизом. 7. На основании наблюдений сделать вывод о свойствах мембран цитоплазмы. Работа 3 Материалы и оборудование. Раствор NaCl (1 M); градуированные пипетки на 5 и 10 мл; глазная пипетка; препаровальная игла; бритва, скальпель; микроскоп; фильтровальная бумага; предметные и покровные стекла; часы. Порядок работы 1. В пробирках приготовить по 10 мл 0,7; 0,6; 0,5; 0,4; 0,3 и 0,2 М растворов NaCl путем разбавления 1 М раствора дистиллированной водой.
2. Пробирки расположить в порядке возрастания концентрации и обязательно подписать карандашом по стеклу. 3. На выпуклой поверхности чешуи луковицы лезвием сделать надрез и аккуратно снять кусочек эпидермиса. 4. Полученный фрагмент ткани поместить на предметное стекло в каплю воды. Рассмотреть препарат под микроскопом при малом увеличении. 5. С одной стороны покровного стекла, не сдвигая препарата, кусочком фильтровальной бумаги удалить воду и внести 0,2 М раствор соли. 6. По истечению 10 мин кусочком фильтровальной бумаги удалить 0,2 М раствор и последовательно вносить растворы в порядке возрастания их концентрации с интервалом в 10 мин, по истечении которого рассмотреть препарат в микроскоп. Целью этой операции является нахождение изотонической концентрации (c) как среднее арифметическое между концентраций раствора, в котором плазмолиз ещё не происходит, и концентрацией раствора, при действии которого уже наблюдается начальный уголковый плазмолиз.
7. Результаты опыта записать по форме (Табл. 2). 8. Сделать выводы по результатам работы.
Таблица 2. Определение потенциального осмотического давления
Работа 4 Порядок работы. 1. У валлиснерии отрезать кусочек листа, у элодеи отделить лист недалеко от верхушечной почки. 2. Поместить на предметное стекло в капле воды, взятой из сосуда, в котором находилось растение. 3. Через 10 мин когда установится стационарный уровень движения цитоплазмы, рассмотреть клетки листа под микроскопом. Выбрать наиболее легко просматриваемые участки (у элодеи это чаще всего клетки средней жилки) и по движению хлоропластов проследить движение цитоплазмы. 4. Определить скорость движения хлоропластов, измерив путь, который проходит органелла в единицу времени. Для большей точности измерения нужно взять относительно короткий участок пути, например, равный десяти делениям окуляр-микрометра. Провести подсчет для пяти органелл в пяти клетках, полученные данные обработать статистически, вычислив среднее арифметическое М, среднее квадратичное σ и среднюю ошибку т: M = где σ= ± m = σ /
5. Каплю раствора АТФ поместить с одной стороны покровного стекла и одновременно оттянуть фильтровальной бумагой воду из-под стекла с другой стороны. Через 10 мин определить скорость движения цитоплазмы. 6. Проделать подобный опыт с раствором ДНФ. 7. Веточку элодеи (или лист валлиснерии) опустить в стакан с водой, находящийся в термостате при 37° С, и оставить на 20 мин. 8. Отделить лист, положить на предметное стекло в каплю воды, быстро определить скорость движения цитоплазмы.
9. Контрольное определение скорости движения цитоплазмы (без обработки) провести так же, как описано в пунктах 1-4. 10. Оттянуть воду фильтровальной бумагой и прилить раствор 6-БАП в концентрации 10 мг/л. Через 10 мин определяют скорость движения цитоплазмы. 11. Определить действие другой концентрации 6-БАП - 100 мг/л на новом кусочке листа, также предварительно определив скорость движения цитоплазмы в контроле. 12. Представить результаты в виде таблиц.
13. Сделать выводы.
Раздел 2. Фотосинтез Работа 5 Материалы и оборудование Этиловый спирт (96%); ступка фарфоровая; пробирки; воронка; ножницы; фильтровальная бумага Порядок работы 1. Сухие или свежие листья нарезать ножницами на мелкие кусочки. 2. Добавить небольшое количество MgCО3 или СаСО3. 3. Растереть листья в фарфоровой ступке. 4. Прилить 2 – 3 мл спирта. 5. Продолжить растирание. 6. Добавить 15 - 20 мл спирта. 7. Осторожно продолжать растирание, пока спирт не окрасится в интенсивный зеленый цвет 8. Полученную спиртовую вытяжку отфильтровать через фильтровальную бумагу, предварительно смоченную этиловым спиртом, в сухую пробирку.
Работа 6 Разделение пигментов (по методу Крауса)
Метод основан на различной растворимости пигментов в спирте и бензине. Сродство пигментов к полярным (спирт, ацетон) и неполярным (бензин, петролейный эфир) растворителям определяется степенью их полярности. Ксантофиллы, содержащие две или более полярных групп, хорошо растворимы в спирте, в то время как каротин отличается более высоким сродством к бензину. Фитольный остаток в молекуле хлорофилла представляет её гидрофобную часть и обусловливает возможность взаимодействия молекулы этого пигмента с бензином. Этиловый спирт и бензин не смешиваются, а образуют две фазы - верхнюю бензиновую и нижнюю спиртовую, благодаря чему разделяются компоненты смеси пигментов. Спиртовый слой будет окрашен в золотисто-желтый цвет от присутствия в нем ксантофилла, а верхний - бензиновый слой будет зеленый от хлорофилла. Окраска второго желтого пигмента – каротина (также перешедшего в бензиновый слой) будет маскироваться окраской хлорофилла.
Цель работы. Показать различное сродство фотосинтетических пигментов к полярным и неполярным растворителям. Объект исследования. Спиртовая вытяжка пигментов листа Материалы и оборудование. Бензин; штатив с пробирками. Порядок работы 1. В пробирку налить 1 мл спиртового экстракта пигментов, добавить 1 мл бензина. 2. Содержимое пробирки сильно встряхнуть, предварительно закрыв её пробкой. 3. Дождаться разделения фаз растворителей. 4. Если разделение пигментов идет плохо, добавить воды (2—3 капли) и снова интенсивно встряхнуть. При избытке воды возможно помутнение нижнего слоя. В этом случае прилить немного этилового спирта и перемешать содержимое пробирки. 5. Зарисовать картину распределения пигментов. 6. Сделать вывод о свойствах молекул фотосинтетических пигментов.
Работа 7 Влияние щелочи на хлорофилл
Обрабатывая хлорофилл щелочью, можно вызвать омыление эфирных групп, т. е. отщепление остатков метилового спирта и фитола:
Mg N4 O H30 C32 + 2Na OH ® COO CH3
® Mg N4 O H30 C32 + C20 H39 OH + CH3 OH COONa
Образующаяся при этом соль хлорофиллиновой кислоты сохраняет зеленую окраску и оптические свойства хлорофилла,но отличается от него большей гидрофильностью. В бензиновый слой переходят каротин и ксантофилл, а в спиртовой - натриевая соль хлорофиллиновой кислоты. Цель работы. Показать химические свойства хлорофилла, как сложного эфира, определить хромофорную и способную растворяться в полярных растворителях часть молекулы хлорофилла.
Объект исследования. Спиртовая вытяжка пигментов листа Материалы и оборудование. Бензин; штатив с пробирками; NaOH (таблетированный); пинцет Порядок работы 1. Провести разделение пигментов по Краусу (см. раб. 6). 2. Пинцетом положить в пробирку со спиртово–бензиновой смесью пигментов 1 таблетку NaOH. Закрыть пробирку резиновой пробкой. ВНИМАНИЕ! Работать со щелочью следует крайне осторожно! 3. Дождаться частичного растворения щелочи в нижнем (спиртовом) слое смеси. 4. Покачиванием пробирки перемешать её содержимое. 5. Дать отстояться. 6. Зарисовать окраску слоев, указав распределение пигментов. 7. Сделать вывод о свойствах молекулы хлорофилла, обнаруживаемые при действии на неё щелочи.
Работа 8 Порядок работы 1. В две пробирки налить по 1 мл спиртовой вытяжки пигментов. 2. Добавить по одной капле 10 %-го раствора соляной кислоты. 3. Одну из пробирок с полученным феофитином оставить для контроля. 4. Во вторую пробирку внести несколько кристаллов ацетата меди и осторожно нагреть раствор на спиртовке до кипения. 5. Зарисовать окраску феофитина и медь-производного хлорофилла.
6. Сделать вывод о значении атома тяжелого металла для молекулы хлорофилла.
Работа 9 Порядок работы. Работа 10 Порядок работы.
Работа 11 Флуоресценция хлорофилла
Флуоресценция — испускание света возбужденной молекулой хлорофилла. Суть явления в следующем. При комнатной температуре и в темноте молекула хлорофилла находится в основном состоянии, т. е. энергия ее соответствует нижнему синглетному уровню (S0). Поглощение кванта света сопровождается переходом одного из p-электронов на более высокий энергетический уровень. В результате возникает синглетное электронно-возбужденное состояние молекулы. Синглетным называют такое возбужденное состояние, при котором переход электрона на более высокий энергетический уровень не сопровождается изменением знака спина. В спектрах поглощения ему соответствует одна линия. Если при этом поглощается квант красного света, то электрон переходит на первый синглетный уровень (S1) с энергией 1,7 эВ и временем жизни 10-8 – 10-9 с. В случае захвата кванта синего свет, электрон оказывается на втором синглетном уровне (S2) с энергией 2,9 эВ, а время жизни электрона в таком состоянии уменьшается до 10-12 – 10-13 с. Независимо от того, в какое электронно-возбужденное состояние молекула была переведена поглощенным квантом, она, в конечном счете, переходит на низший колебательный подуровень первого синглетного возбужденного состояния (S1). Энергия этого состояния может использоваться на осуществление фотохимические процессов, мигрировать от одной молекулы хлорофилла к другой, растрачиваться в виде тепла или флуоресцентного излучения. В последнем случае электрон возвращается в исходное положение. Таким образом, независимо от длины возбуждающего света хлорофилл флуоресцирует только в красной части спектра. Уменьшение энергии кванта, излученного возбужденной молекулой, по сравнению с энергией поглощенного кванта получило название стоксового сдвига. Флуоресцируют только хлорофилл а и хлорофилл b; каротиноиды не обладают этой способностью. В живом листе основным флуоресцирующим пигментом служит хлорофилл а. При этом в листьях флуоресценция выражена гораздо слабее, чем в растворе, так как часть поглощенной энергии используется на сенсибилизацию фотохимических реакций. Поэтому возрастание интенсивности фотосинтеза, как правило, влечет за собой ослабление флуоресценции. Изучение флуоресценции дает ценные сведения не только об использовании энергии в фотохимических процессах, но и о характере взаимодействия молекул различных пигментов в ламеллах тилакоидов хлоропласта, миграции энергии в фотосистемах и пр. Цель работы. Показать флуоресценцию хлорофилла Объект исследования. Спиртовая вытяжка пигментов листа Материалы и оборудование. Пробирка; источник яркого света. Порядок работы 1. Спиртовую вытяжку пигментов поместить у источника освещения и рассматривать в отраженном свете. 2. Отметить темно-красный цвет флуоресцирующего раствора хлорофилла. 3. Сделать вывод по результатам опыта. Раздел 3. Дыхание растений
Дыханием называют окислительный распад сложных органических веществ, в первую очередь углеводов, до простейших конечных продуктов - диоксида углерода и воды, сопровождающийся выделением энергии. Суммарно его выражают уравнением С6Н12О6 + 6О2 ® 6СО2 + 6Н2O + 2875 кДж Процесс представляет сложные превращения, протекающие в определенной последовательности при участии многих ферментов. Значительная часть энергии, освобождающейся в результате окисления органических веществ, фиксируется в макроэргических фосфатных связях АТФ и используется на различные жизненные процессы растений. Образование АТФ происходит с потреблением кислорода. В анаэробных условиях или при подавлении дыхания действием различных химических веществ реакция не идет. В связи с тем, что фосфорилирование с образованием АТФ происходит лишь при окислении органических веществ, процесс получил название окислительного фосфорилирования. Данный процесс протекает в основном в митохондриях при окислении водорода, отнятого от дыхательного субстрата при участии дегидрогеназ, до воды с участием цитохромной системы. В дыхательной цепи происходит три реакции фосфорилирования. Многоступенчатый перенос водорода и электрона способствует постепенному выделению энергии малыми порциями, что создает условия для эффективного использования ее в клетке. Окислительное фосфорилирование - очень неустойчивый процесс. При повреждении внутриклеточных структур образование АТФ немедленно прекращается. Объясняется это тем, что окислительное фосфорилирование происходит только в неповрежденных митохондриях. Митохондрии - основные центры накопления энергии в клетке, и при нарушении их структуры указанный процесс прекращается. Часть образующихся в процессе дыхания восстановленных коферментов (НАДН и особенно НАДФН) используется на восстановительные процессы: восстановление нитратов до аммиака, восстановительное аминирование кетокислот и др. Постепенный распад сахаров сопровождается образованием разнообразных промежуточных продуктов, необходимых для синтеза аминокислот, белков, жиров, углеводов и других веществ. Будучи тесно связанным со всей жизнедеятельностью растений, дыхание наряду с фотосинтезом оказывает непосредственное влияние на их продуктивность. Дыханию принадлежит важная роль в обеспечении защитных реакций растений. Наиболее общий показатель скорости окисления - интенсивность дыхания, о которой можно судить по поглощению кислорода, выделению диоксида углерода и окислению органического вещества. Другие показатели дыхательного метаболизма: величина дыхательного коэффициента, соотношение гликолитического и пентозофосфатного путей распада сахаров, активность окислительно-восстановительных ферментов. Об энергетической эффективности дыхания можно судить по интенсивности окислительного фосфорилирования митохондрий. Перечисленные показатели могут быть использованы для характеристики физиологических свойств и состояния растений.
Работа 12 Определение интенсивности дыхания семян в закрытом сосуде Метод определения скорости дыхания семян заключается в учете количества СО2, выделяемого семенами при дыхании. При поглощении диоксида углерода баритом происходит следующая реакция: Ва(ОН)2 + СО2 ® ВаСО3 + H2O Избыток барита, не прореагировавшегос СО2, оттитровывают щавелевой кислотой: Ва(ОН)2 + Н2С2О4 ® ВаС2О4 + 2Н2О Цель работы. Определить скорость дыхания прорастающих семян, отличающихся по химическому составу основных запасных веществ.
Объект исследования. Прорастающие семена пшеницы и подсолнечника. Материалы и оборудование. Ва(ОН)2 (0,1 н.); щавелевая кислота (0,1 н.); фенолфталеин (1 %); весы с разновесами; конические колбы на 250 мл с пробками, снабженными крючком; куски марли (10 ´ 10 см)
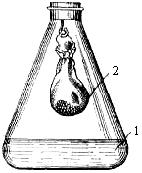
Порядок работы. 1. Взвесить 4 грамма проросших семян. 2. Поместить навеску семян в центр куска марли. Соединить концы марли, сделав мешочек. 3. При помощи бюретки налить в две колбы по 10 мл 0,1 н. Ва(ОН)2. Закрыть колбы пробками. Внимание! Барит ядовит! Его нельзя оставлять открытым, так как он легко поглощает СО2 из воздуха. 4. В одну колбу быстро подвесить на крючок пробки мешочек с семенами (рис. 5), другую колбу оставить в качестве контроля. 5. Выдержать обе колбы 1 ч при комнатной температуре (20 °С). В течение опыта периодически осторожно покачивать колбы, чтобы разрушить пленку ВаСО3 на поверхности барита и препятствующую полноте поглощения CO2. 6. Извлечь из колбы мешочек с семенами, добавить три капли фенолфталеина в каждую колбу.
где, a и b – объем 0,1 н. щавелевой кислоты, израсходованной на титрование барита соответственно в контрольном и опытном вариантах, мл; К - поправка к титру 0,1 н. раствора барита (см. п. 8); 2,2 - количество СО2, мг, соответствующее 1мл 0,1 н. раствора щавелевой кислоты; п - масса навески семян, г; t – продолжительность опыта, ч. 10. Записать результаты опыта по форме (Табл. 6).
Таблица 6. Определение интенсивности дыхания
11. Сделать вывод, сравнив интенсивность дыхания разных объектов.
Работа 13 Порядок работы 1. Пробирку наполовину заполнить прорастающими семенами подсолнечника или пшеницы. Семена не должны лежать плотно! 2. Плотно закрыть пробирку резиновой пробкой с измерительной трубкой. При необходимости нанести каплю воды в местах соприкосновения пробирки и резиновой пробки, стеклянной трубки и резиновой пробки для создания герметичности. 3. Во время опыта поддерживать постоянную температуру внутри пробирки. До начала опыта прибор на 5 мин поместить в штатив колбу и не нагревать руками или дыханием. 4. В первой части опыта на кончик трубки нанести каплю раствора метиленового синего. 5. Измерить, на сколько делений шкалы продвинется капля внутрь трубки за 2 мин. Для получения точного результата вычислить среднюю величину из нескольких отсчетов. Полученная величина (А) выражает разницу между объемом поглощенного при дыхании O2 и объемом выделенного CO2. 6. Во второй части опыта открыть пробирку с семенами и вложить в нее пинцетом свернутую в кольцо полоску фильтровальной бумаги, смоченную 20%-м раствором KOH. 7. Закрыть пробирку, герметизировать систему с помощью нескольких капель воды. Термостатировать. 8. Нанести на кончик измерительной трубки каплю раствора метиленового синего. 9. Измерить, на сколько делений шкалы продвинется капля внутрь трубки за 2 мин. Для получения точного результата вычислить среднюю величину из нескольких отсчетов. Полученная величина ( B ) выражает объем поглощенного при дыхании O2 (т.к. выделенный CO2 поглощается щелочью). 10. Рассчитать величину дыхательного коэффициента по формуле:
ДК = V co2 / V o2 = (B - A) / B. 11. Записать результаты опыта по форме.
Табл. 7 Определение дыхательного коэффициента
12. Сделать вывод, сравнив величины дыхательных коэффициентов разных объектов.
Работа 14 Порядок работы. 1. Навеску растительного материала (50 - 100 мг) растереть в ступке в 5 мл фосфатного буфера. 2. Растертую массу перенести количественно в мерную пробирку, довести пробу буфером до метки 10 мл, перемешать, поместить в холодильник (4°С) на 10 - 15 мин. 3. Центрифугировать 10 мин при 4000 об/мин. Использовать супернатант для определения активности фермента. 4. Исследовать активность фермента на ФЭКе (λ=440 нм) по времени развития окраски до определенного значения оптической плотности (значение D выбрать в зависимости от скорости развития окраски в пределах от 0,25 до 0,4). 5. Для анализа каждой биологической пробы использовать три одинаковые кюветы ФЭКа: одна - контрольная, две другие - опытные (две аналитические повторности из одной биологической пробы). 6. Во все три кюветы внести: 2 мл вытяжки; 2 мл буферного раствора, 2 мл гваякола. 7. В контрольную кювету прилить 2 мл воды и установить ее в контрольную (дальнюю) кюветную подставку ФЭКа. Ввести кювету в световой луч. 8. Закрыть кюветную камеру, установить нуль на шкале оптической плотности по контрольному образцу. 9. Одну из опытных кювет поставить в держатель и ввести в световой луч. 10. Автоматической пипеткой внести в опытную кювету 2 мл раствора Н2O2 и одновременно включить секундомер. 11. Закрыть кюветную камеру и по шкале оптической плотности следить за развитием окраски. 12. По секундомеру отметить время достижения необходимой оптической плотности. 13. Аналогично провести измерение для второй опытной кюветы. 14. Провести расчет активности по формуле
А= где А - активность, выраженная в относительных единицах на 1 г сырой массы за 1 с; D - зарегистрированная в опыте оптическая плотность; t - время, с; d - толщина слоя жидкости (толщина кюветы), см; α, β, γ - факторы разведения: α - отношение количества жидкости, взятой для приготовления вытяжки, мл, к массе навески, г; β - степень дополнительного разведения вытяжки после центрифугирования (если это требовалось); γ - степень постоянного разведения вытяжки в кювете (в данной работе равна 4). 15. Представить результаты в виде таблицы (составить самостоятельно). 16. Сделать выводы о зависимости активности фермента от исследуемых физиологических факторов.
Раздел 4. Водный обмен
Все физиологические процессы в растении нормально протекают лишь, при оптимальном его обеспечении водой. Вода - не только растворитель, но и активный структурный компонент клетки. Она участвует в биологических превращениях, например, облегчает взаимодействие между молекулами, служит субстратом для фотосинтеза, участвует в дыхании и многочисленных гидролитических и синтетических процессах. Вода обладает очень высокой теплоемкостью, поэтому способствует стабилизации температуры растения. Пронизывая все органы, она создает в растении непрерывную фазу, обеспечивая связь органов друг с другом, а также возможность передвижения по растению питательных веществ. Вода играет существенную роль в сохранении формы травянистых растений, поддерживая их клетки в состоянии тургора. Водный баланс растения определяется соотношением между поглощением и выделением воды. Для сведения водного баланса без дефицита необходимо, чтобы расходование влаги листьями компенсировалось ее поглощением через корни. Подвядание растений приводит к серьезным нарушениям в ультраструктуре клеток и обмене веществ. Даже кратковременный недостаток влаги не проходит для растения бесследно. После установления оптимальных условий водоснабжения фотосинтез восстанавливается лишь через пять - семь дней, рост - через две - три недели, что приводит к значительной потере урожая. Вода поступает в растение в результате корневого давления и присасывающего действия транспирации. Деятельность нижнего концевого двигателя, состоящая в активном поглощении воды корневой системой, проявляется в плаче и гуттации растений. Силу, поднимающую воду вверх по сосудам, называют корневым давлением. Величина его обычно составляет 50 - 150 кПа. Корневое давление имеет большое значение в поглощении воды растением при подземном прорастании и в весеннее время до распускания листьев. Существенна роль корневого давления в поддержании непрерывности водных нитей в сосудах ксилемы. Корневое давление ликвидирует в ночные часы возникший за день водный дефицит. Работа верхнего концевого двигателя обусловлена испарением воды с поверхности листа (транспирацией). Присасывающее действие транспирации передается корням в форме гидродинамического натяжения, связывающего работу обоих двигателей. Работа верхнего концевого двигателя, основанная па использовании в качестве источника энергии солнечной радиации, регулируется автоматически (усиление потери влаги снижает водный потенциал испаряющих клеток, что ведет к усилению поступления в них воды). У хорошо облиственных растений присасывающая сила транспирации во много раз превосходит силу корневого давления. Основную роль в испарении воды растениями играют устьица. Поэтому интенсивность транспирации в значительной степени зависит от степени их открытости. Кроме того, растение может уменьшать транспирацию, снижая испарение воды с поверхности клеток в межклетники за счет возрастания водоудерживающей способности протоплазмы и клеточных стенок.
Работа 15 Порядок работы 1. В пробирках приготовить по 10 мл 0,6; 0,5; 0,4; 0,3 0,2 и 0,1 М растворов NaCl путем разбавления 1 М раствора дистиллированной водой. 2. Пробирки расположить в порядке возрастания концентрации и обязательно подписать с помощью карандаша по стеклу. 3. Вырезать из клубня двенадцать полосок длиной 4 - 6 см и поперечным сечением около 4 мм2. Концы полосок срезать наискось. Работа 16 Материалы и оборудование. Раствор NaCl (1 М); метиленовая синяя (кристаллический); штатив с 10 пробирками на 10 мл; градуированные пипетки на 5 и 10 мл; мерные пипетки на 0,5 мл; пробковые сверла диаметром 0,9 мл; пинцет; резиновая пластинка; проволока длиной 15 см; часы Порядок работы 1. Расставить пробирки в штативе в два ряда: пять вверху и пять внизу. 2. В верхних приготовить по 10 мл растворов NaCl: 0,5; 0,4; 0,3; 0,2 и 0,1 М, путем разбавления 1 М раствора дистиллированной водой. Подписать пробирки карандашом по стеклу. 3. Из пробирок верхнего ряда перенести по 0,5 мл раствора в пробирки нижнего ряда. 4. Лист растения положить на резиновую пластинку нижней стороной вверх. 5. Пробковым сверлом вырезать по 10 одинаковых дисков. Диски вырезать между крупными дисками. 6. В каждую пробирку нижнего ряда опустить по два диска на 40 мин. Встряхивать пробирки каждые 10 мин. 7. Через 40 мин пинцетом удалить листовые диски из пробирок. 8. Окрасить растворы в нижнем ряду пробирок кристаллической метиленовой синей (взятой на кончике проволоки). Встряхивать окрашенный раствор до равномерного распределения красителя. 9. В пипетку на 0,5 мл набрать окрашенный раствор.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.228.35 (0.212 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
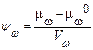
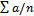
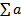 - сумма отдельных измерений, п — число измерений.
- сумма отдельных измерений, п — число измерений.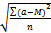
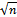
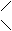 COO C20 H39
COO C20 H39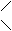 COONa
COONa