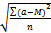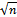Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение скорости движения цитоплазмы
Движение цитоплазмы, происходящее в клетках в естественных условиях, называют первичным. Движение же, индуцированное каким-либо фактором внешней среды (светом, температурой, химическим или механическим воздействием и т. п.), - вторичным. Скорость движения цитоплазмы увеличивается с повышением температуры до определенного предела последней (чаще 27 - 37°С). При дальнейшем увеличении температуры движение замедляется, а затем прекращается. Свет может либо ускорить движение (фотодинез), либо замедлить и остановить его. Характер реакции зависит от количества световой энергии и качественного состава света. Различные химические агенты, физические факторы также влияют на движение цитоплазмы. В организации движения цитоплазмы участвуют белки, образующие цитоскелет клетки. Механизм, приводящий в движение цитоплазму, находится на поверхности раздела эктоплазмы и эндоплазмы. Источником энергии для движения протоплазмы является АТФ. Поэтому свет может влиять на скорость этого движения,, изменяя уровень АТФ, образованной в процессе фотосинтетического фосфорилирования. Различные ингибиторы и разобщители дыхания тормозят движение цитоплазмы во многих растительных клетках, что также свидетельствует об энергозависимости процесса. Так, 2,4-динитрофенол (ДНФ) - широко применяемый разобщитель дыхания и фосфорилирования - тормозит движение цитоплазмы в концентрациях 10-4 – 10-3 М. Его действие обратимо: после удаления реагента скорость движения восстанавливается. Движение цитоплазмы можно охарактеризовать, определив его скорость. Однако нельзя забывать о том, что последняя зависит не только от движущей силы, но и от вязкости цитоплазмы. Скорость движения цитоплазмы можно измерить под микроскопом, наблюдая за передвижением ее частиц.
Цель работы. Показать зависимость скорости движения цитоплазмы с уровнем жизнедеятельности клетки, с затратой её энергии. Изучить влияние различных концентраций фитогормонов (цитокининов, фузикокцина) или синтетических регуляторов роста на скорость движения цитоплазмы.
Объект исследования. Листья элодеи Elodea canadensis или валлиснерии Vallisneria spiralis
Материалы и оборудование. 5×10 - 3 М раствор АТФ; 5×10-4 М раствор ДНФ; 6-бензиламинопурин (6-БАП) в концентрациях 10 и 100 мг/л; ножницы; лезвия; секундомеры; капилляры; предметные и покровные стекла; пробирки; термостат с температурой 37°С; микроскопы.
Порядок работы. 1. У валлиснерии отрезать кусочек листа, у элодеи отделить лист недалеко от верхушечной почки. 2. Поместить на предметное стекло в капле воды, взятой из сосуда, в котором находилось растение. 3. Через 10 мин когда установится стационарный уровень движения цитоплазмы, рассмотреть клетки листа под микроскопом. Выбрать наиболее легко просматриваемые участки (у элодеи это чаще всего клетки средней жилки) и по движению хлоропластов проследить движение цитоплазмы. 4. Определить скорость движения хлоропластов, измерив путь, который проходит органелла в единицу времени. Для большей точности измерения нужно взять относительно короткий участок пути, например, равный десяти делениям окуляр-микрометра. Провести подсчет для пяти органелл в пяти клетках, полученные данные обработать статистически, вычислив среднее арифметическое М, среднее квадратичное σ и среднюю ошибку т: M = где σ= ± m = σ /
5. Каплю раствора АТФ поместить с одной стороны покровного стекла и одновременно оттянуть фильтровальной бумагой воду из-под стекла с другой стороны. Через 10 мин определить скорость движения цитоплазмы. 6. Проделать подобный опыт с раствором ДНФ. 7. Веточку элодеи (или лист валлиснерии) опустить в стакан с водой, находящийся в термостате при 37° С, и оставить на 20 мин. 8. Отделить лист, положить на предметное стекло в каплю воды, быстро определить скорость движения цитоплазмы. 9. Контрольное определение скорости движения цитоплазмы (без обработки) провести так же, как описано в пунктах 1-4. 10. Оттянуть воду фильтровальной бумагой и прилить раствор 6-БАП в концентрации 10 мг/л. Через 10 мин определяют скорость движения цитоплазмы. 11. Определить действие другой концентрации 6-БАП - 100 мг/л на новом кусочке листа, также предварительно определив скорость движения цитоплазмы в контроле. 12. Представить результаты в виде таблиц.
13. Сделать выводы.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 709; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.83.150 (0.006 с.) |
|||||||||||||||||||||||||||||||||||||
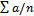
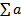 - сумма отдельных измерений, п — число измерений.
- сумма отдельных измерений, п — число измерений.