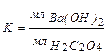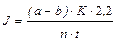Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть II . Получение хроматограммы пигментов. Определение концентрации каротиноидов
1.Для хроматографического разделения пигментов использовать силуфоловые пластинки размером 15×15 см. Вытяжку пигментов нанести капилляром по всей ширине пластинки, отступив 2 - 3 см от нижнего края пластинки и по 1 см от боковых краев. Объем наносимой вытяжки: 0,5 - 0,8 мл. 2. Тщательно просушить пластинку в токе воздуха (использовать фен).
3. Провести разделение пигментов в хроматографической камере, предварительно насыщенной парами смеси бензина, ацетона, петролейного эфира и гексана в соотношении 10: 10: 10: 3. Порядок расположения отдельных зон пигментов представлен на рис. 4. Для количественного определения каротиноидов получить две-три хроматограммы. 4. Для определения концентрации каротиноидов окрашенные зоны, соответствующие каротину и ксантофиллам (неоксантин, виолаксантин, антероксантин, лютеин+зеаксантин), соскоблить скальпелем с 2 - 3 хроматограмм, зоны одноименных пигментов соединить и поместить в пробирки с притертыми пробками. 5. Элюировать пигменты путем встряхивания пробирок следующими растворителями: каротин - петролейным эфиром, ксантофиллы - этанолом. 6. Элюат центрифугировать 7. Супернатант промерить на спектрофотометре: каротин - при 452 нм, лютеин - 445, виолаксантин - 442, неоксантин - при 438 нм. 8. Рассчитать концентрацию пигментов С (г/л) по формуле
С = D / а × l, где D — оптическая плотность при соответствующей длине волны; а - удельный коэффициент погашения, л×г-1×см-1 (для каротина - 260, лютеина - 258, виолаксантина - 225, неоксантина - 227); l — толщина слоя раствора, см. 9. Определить содержание каротиноидов на 1 г сырой массы растительного материала А (мг/г) по формуле
A = C × V × K / P,
где С - концентрация пигментов, г/л; V - объем вытяжки, мл; К - отношение объема элюата к общему объему вытяжки, нанесенному на хроматограммы; Р - навеска растительного материала, г (0,5 г). 10. Заполнить таблицу 5
Таблица 5. Расчет содержания пигментов в растении
11. Сделать выводы.
Работа 11 Флуоресценция хлорофилла
Флуоресценция — испускание света возбужденной молекулой хлорофилла. Суть явления в следующем. При комнатной температуре и в темноте молекула хлорофилла находится в основном состоянии, т. е. энергия ее соответствует нижнему синглетному уровню (S0). Поглощение кванта света сопровождается переходом одного из p-электронов на более высокий энергетический уровень. В результате возникает синглетное электронно-возбужденное состояние молекулы. Синглетным называют такое возбужденное состояние, при котором переход электрона на более высокий энергетический уровень не сопровождается изменением знака спина. В спектрах поглощения ему соответствует одна линия. Если при этом поглощается квант красного света, то электрон переходит на первый синглетный уровень (S1) с энергией 1,7 эВ и временем жизни 10-8 – 10-9 с. В случае захвата кванта синего свет, электрон оказывается на втором синглетном уровне (S2) с энергией 2,9 эВ, а время жизни электрона в таком состоянии уменьшается до 10-12 – 10-13 с. Независимо от того, в какое электронно-возбужденное состояние молекула была переведена поглощенным квантом, она, в конечном счете, переходит на низший колебательный подуровень первого синглетного возбужденного состояния (S1). Энергия этого состояния может использоваться на осуществление фотохимические процессов, мигрировать от одной молекулы хлорофилла к другой, растрачиваться в виде тепла или флуоресцентного излучения. В последнем случае электрон возвращается в исходное положение. Таким образом, независимо от длины возбуждающего света хлорофилл флуоресцирует только в красной части спектра. Уменьшение энергии кванта, излученного возбужденной молекулой, по сравнению с энергией поглощенного кванта получило название стоксового сдвига. Флуоресцируют только хлорофилл а и хлорофилл b; каротиноиды не обладают этой способностью. В живом листе основным флуоресцирующим пигментом служит хлорофилл а. При этом в листьях флуоресценция выражена гораздо слабее, чем в растворе, так как часть поглощенной энергии используется на сенсибилизацию фотохимических реакций. Поэтому возрастание интенсивности фотосинтеза, как правило, влечет за собой ослабление флуоресценции. Изучение флуоресценции дает ценные сведения не только об использовании энергии в фотохимических процессах, но и о характере взаимодействия молекул различных пигментов в ламеллах тилакоидов хлоропласта, миграции энергии в фотосистемах и пр.
Цель работы. Показать флуоресценцию хлорофилла Объект исследования. Спиртовая вытяжка пигментов листа Материалы и оборудование. Пробирка; источник яркого света. Порядок работы 1. Спиртовую вытяжку пигментов поместить у источника освещения и рассматривать в отраженном свете. 2. Отметить темно-красный цвет флуоресцирующего раствора хлорофилла. 3. Сделать вывод по результатам опыта. Раздел 3. Дыхание растений
Дыханием называют окислительный распад сложных органических веществ, в первую очередь углеводов, до простейших конечных продуктов - диоксида углерода и воды, сопровождающийся выделением энергии. Суммарно его выражают уравнением С6Н12О6 + 6О2 ® 6СО2 + 6Н2O + 2875 кДж Процесс представляет сложные превращения, протекающие в определенной последовательности при участии многих ферментов. Значительная часть энергии, освобождающейся в результате окисления органических веществ, фиксируется в макроэргических фосфатных связях АТФ и используется на различные жизненные процессы растений. Образование АТФ происходит с потреблением кислорода. В анаэробных условиях или при подавлении дыхания действием различных химических веществ реакция не идет. В связи с тем, что фосфорилирование с образованием АТФ происходит лишь при окислении органических веществ, процесс получил название окислительного фосфорилирования. Данный процесс протекает в основном в митохондриях при окислении водорода, отнятого от дыхательного субстрата при участии дегидрогеназ, до воды с участием цитохромной системы. В дыхательной цепи происходит три реакции фосфорилирования. Многоступенчатый перенос водорода и электрона способствует постепенному выделению энергии малыми порциями, что создает условия для эффективного использования ее в клетке. Окислительное фосфорилирование - очень неустойчивый процесс. При повреждении внутриклеточных структур образование АТФ немедленно прекращается. Объясняется это тем, что окислительное фосфорилирование происходит только в неповрежденных митохондриях. Митохондрии - основные центры накопления энергии в клетке, и при нарушении их структуры указанный процесс прекращается. Часть образующихся в процессе дыхания восстановленных коферментов (НАДН и особенно НАДФН) используется на восстановительные процессы: восстановление нитратов до аммиака, восстановительное аминирование кетокислот и др. Постепенный распад сахаров сопровождается образованием разнообразных промежуточных продуктов, необходимых для синтеза аминокислот, белков, жиров, углеводов и других веществ. Будучи тесно связанным со всей жизнедеятельностью растений, дыхание наряду с фотосинтезом оказывает непосредственное влияние на их продуктивность. Дыханию принадлежит важная роль в обеспечении защитных реакций растений.
Наиболее общий показатель скорости окисления - интенсивность дыхания, о которой можно судить по поглощению кислорода, выделению диоксида углерода и окислению органического вещества. Другие показатели дыхательного метаболизма: величина дыхательного коэффициента, соотношение гликолитического и пентозофосфатного путей распада сахаров, активность окислительно-восстановительных ферментов. Об энергетической эффективности дыхания можно судить по интенсивности окислительного фосфорилирования митохондрий. Перечисленные показатели могут быть использованы для характеристики физиологических свойств и состояния растений.
Работа 12 Определение интенсивности дыхания семян в закрытом сосуде Метод определения скорости дыхания семян заключается в учете количества СО2, выделяемого семенами при дыхании. При поглощении диоксида углерода баритом происходит следующая реакция: Ва(ОН)2 + СО2 ® ВаСО3 + H2O Избыток барита, не прореагировавшегос СО2, оттитровывают щавелевой кислотой: Ва(ОН)2 + Н2С2О4 ® ВаС2О4 + 2Н2О Цель работы. Определить скорость дыхания прорастающих семян, отличающихся по химическому составу основных запасных веществ.
Объект исследования. Прорастающие семена пшеницы и подсолнечника. Материалы и оборудование. Ва(ОН)2 (0,1 н.); щавелевая кислота (0,1 н.); фенолфталеин (1 %); весы с разновесами; конические колбы на 250 мл с пробками, снабженными крючком; куски марли (10 ´ 10 см)
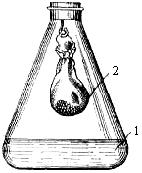
Порядок работы. 1. Взвесить 4 грамма проросших семян. 2. Поместить навеску семян в центр куска марли. Соединить концы марли, сделав мешочек. 3. При помощи бюретки налить в две колбы по 10 мл 0,1 н. Ва(ОН)2. Закрыть колбы пробками. Внимание! Барит ядовит! Его нельзя оставлять открытым, так как он легко поглощает СО2 из воздуха. 4. В одну колбу быстро подвесить на крючок пробки мешочек с семенами (рис. 5), другую колбу оставить в качестве контроля. 5. Выдержать обе колбы 1 ч при комнатной температуре (20 °С). В течение опыта периодически осторожно покачивать колбы, чтобы разрушить пленку ВаСО3 на поверхности барита и препятствующую полноте поглощения CO2. 6. Извлечь из колбы мешочек с семенами, добавить три капли фенолфталеина в каждую колбу.
где, a и b – объем 0,1 н. щавелевой кислоты, израсходованной на титрование барита соответственно в контрольном и опытном вариантах, мл; К - поправка к титру 0,1 н. раствора барита (см. п. 8); 2,2 - количество СО2, мг, соответствующее 1мл 0,1 н. раствора щавелевой кислоты; п - масса навески семян, г; t – продолжительность опыта, ч. 10. Записать результаты опыта по форме (Табл. 6).
Таблица 6. Определение интенсивности дыхания
11. Сделать вывод, сравнив интенсивность дыхания разных объектов.
Работа 13
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-23; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.86.155 (0.029 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||