
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартизация раствора перманганата калияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Стандартизацию раствора KMnO4 можно провести по свежеперекристаллизованной щавелевой кислоте H2C2O4 · 2H2O, ее солям - оксалату натрия Na2C2O4 и оксалату аммония (NH4)2C2O4 ∙ H2O, КI и другим первичным стандартам. Методика определения Приготовление первичного стандартного раствора щавелевой кислоты Рассчитывают навеску щавелевой кислоты, необходимую для приготовления 1л раствора с молярной концентрацией эквивалента С(1/2 H2C2O4· 2H2O) = 0,1000 моль/л. Взвешивают рассчитанное количество вещества, переносят в мерную колбу, растворяют и объем доводят до метки. Стандартизация раствора KMnO4 титрованием В колбу для титрования пипеткой Мора отбирают 10.00 мл стандартного раствора щавелевой кислоты, добавляют мерным цилиндром 10 мл 2 н раствора серной кислоты и раствор осторожно нагревают до 70-80˚С. Бюретку со стеклянным краном заполняют исследуемым раствором KMnO4. Подготовленный раствор в конической колбе титруют перманганатом. При титровании первые капли перманганата обесцвечиваются очень медленно. Поэтому титрование сначала ведется по каплям до полного обесцвечивания раствора. После того, как некоторое количество перманганата прореагировало, и в растворе появились ионы Mn2+, реакция ускоряется, и это дает возможность вести титрование быстрее. Титрование считается законченным, когда появившаяся розовая окраска не исчезает в течение 1 минуты. Определение повторяют не менее трех раз, результаты записывают в таблицу и рассчитывают нормальную концентрацию и титр перманганата калия.
Лабораторная работа Определение содержания железа в растворе Определение железа (II) в почвах, сплавах, рудах, металлах, солях имеет большое практическое значение и считается одним из важнейших применений метода перманганатометрии. Если железо находится в виде трехвалентного иона Fe3+, его восстанавливают до Fe2+, а затем титруют перманганатом калия. Методика определения Исследуемый раствор, содержащий двухвалентное железо, помещают в мерную колбу на 100.0 мл, доводят до метки и тщательно перемешивают. В колбу для титрования переносят 10.00 мл полученного раствора, добавляют 8-10 мл раствора 2 н серной кислоты и титруют стандартизированным раствором перманганата калия до перехода окраски из практически бесцветной в розовую. Титрование проводят не менее трех раз, результаты записывают в таблицу. Рассчитывают нормальную концентрацию и титр железа (II) в исследуемом растворе, а также массу железа, содержащегося в мерной колбе объемом 100,0 мл. Уравнение окислительно-восстановительной реакции, лежащей в основе титрования, и формулы для расчета приведены ранее. 3.4.5. Уровень требований по теме «Перманганатометрия» В результате изучения темы «Перманганатометрия» студент должен: знать: сущность методаперманганатометрии, индикаторы метода, рабочий раствор метода, способы его приготовления, определение окислителей и восстановителей; уметь: готовить стандартные и рабочие растворы метода; собирать титровальную установку, правильно выполнять титрование; проводить стандартизацию раствора перманганата калия по щавелевой кислоте; экспериментально определять содержание соли Fe(II) в растворе, проводить расчеты нормальной концентрации, титра и массы определяемого вещества в исследуемом растворе. владеть: современной химической терминологией в области перманганатометрии; навыками работы с мерной посудой, используемой в данном методе. Иодометрия Иодометрия – это метод окислительно-восстановительного титрования, основанный на выделении или поглощении йода. Особенности иодометрии обусловлены, главным образом, невысокими окислительными способностями йода, хорошей обратимостью реакции, а также слабой зависимостью от рН раствора. Для йодометрических определений характерно равновесие: I2 + 2e =2I--. При этом I2 является средним по силе окислителем, а иодид-анионы (I--) – средними по силе восстановителями. Отсюда иодометрия применяются как для определения восстановителей, так и для определения окислителей. В качестве индикатора в иодометрии обычно используется крахмал, который дает с I2 соединения включения (клатраты) темно-синего цвета. Сам крахмал является очень слабым восстановителем, поэтому при определении окислителей крахмал добавляют в конце титрования в количестве 8-10 капель 1% раствора, а при титровании восстановителей крахмал добавляется в начале титрования. Определение восстановителей Иодометрически определяют следующие сильные восстановители: кислоты H3AsO3, H2SO3, H2S и их соли; Sn2+ и др. При этом AsO33- + H2O – 2e =AsO43- +2H+ SO32- + H2O – 2e = SO42- +2H+ S2- - 2e = S0 Sn2+ - 2e = Sn4+ Определение обычно проводят прямым титрованием. Рабочим раствором (титрантом) служит раствор I2 коричневого цвета. В процессе титрования раствор I2 обесцвечивается. В точке эквивалентности восстановитель и I2 полностью взаимодействуют между собой. Поэтому, добавленная далее одна лишняя капля раствора йода, дает с крахмалом синюю окраску. Титрование считается законченным. Приготовление стандартного раствора I 2 Стандартный раствор I2 можно приготовить: - из фиксанала; - по точной навеске I2, если есть химически чистый или свежеочищенный возгонкой I2 . Такой йод является первичным стандартом; - часто готовят раствор I2 с приблизительной концентрацией с последующей стандартизацией по рабочему раствору тиосульфата натрия Na2S2O3: 2 Na2S2O3 + I2 = 2NaI + Na2S4O6
2 I2 + 2e = 2I- S4O62- - тетратионат – ион; 1/z (Na2S2O3) = 1/1; 1/z (I2) = 1/2. M(1/1 Na2S2O3) = 158.10 г/моль; M(1/1 Na2S2O3∙5H2O) = 248.18 г/моль; M(1/2 I2) =126.90 г/моль. Следует учитывать, что кристаллический I2 плохо растворим в воде, поэтому его растворяют в водном растворе иодида калия. Приготовленный раствор йода хранят в темном прохладном месте в хорошо закрытой бутыли, т.к. I2 летуч. Определение окислителей Иодометрически определяются следующие окислители в почве, воде, удобрениях, пестицидах и других объектах: Cl2, Br2, O2, O3, H2O2, Fe3+, Cu2+ и т.д. Также этот метод используется для определения активного хлора в белильной извести. Прямое титрование окислителей раствором иодида калия не проводят, т.к. окисление иодида протекает медленно, кроме того, растворы KI не устойчивы из-за окисления кислородом воздуха: 4I- + O2 + 4H+ = 2 I2 + 2H2O Поэтому при определении окислителей применяют заместительное титрование: к раствору окислителя добавляют избыток раствора KI, выделившийся в эквивалентном количестве I2 оттитровывают рабочим раствором тиосульфата натрия Na2S2O3. Приготовление рабочего раствора (титранта) Na 2 S 2 O 3 Поступающий в химическую лабораторию реактив Na2S2O3∙5H2O не удовлетворяет требованиям, предъявляемым к первичным стандартам: 1) его кристаллы выветриваются при хранении, часть воды теряется; 2) растворы тиосульфата натрия не устойчивы при хранении: - окисляется кислородом воздуха: 2 Na2S2O3 + O2 = 2Na2SO4 + 2S - разлагаются даже очень слабыми кислотами, например H2CO3: Na2S2O3 + H2CO3 = NaHSO3 + NaHCO3 + S - под действием серных бактерий тиосульфат-ион S2O32- превращается в анионы SO42-, SO32- и S◦. Поэтому приготавливают раствор тиосульфата натрия по приблизительной навеске и выдерживают 1-2 недели в темном месте без доступа воздуха, чтобы прошли все побочные реакции. Затем этот раствор стандартизируют по первичному стандартному раствору K 2 Cr 2 O 7 иодометрически, используя заместительное титрование. Для этого в колбу для титрования помещают 20.00 мл 0.02000 н раствора K2Cr2O7 (окислитель), 15 мл 0.2 н раствора KI (избыток) и 15 мл 2 н раствора H2SO4. Колбу закрывают часовым стеклом и помещают в темное место. Через 2-3 минуты выделившийся I2 титруют раствором Na2S2O3 до светло-желтой окраски. Добавляют 8-10 капель крахмала и продолжают титровать до исчезновения синей окраски индикатора. Протекающие при этом окислительно-восстановительные реакции: 1) В колбе для титрования K2Cr2O7 + 6KI + 7H2SO4 = Cr2(SO4)3 + 3I2 +4K2SO4 +7H2O
3 2I - - 2e = I2 Цвет раствора в колбе – коричневый за счет I2. M(1/6 K2Cr2O7) = 49.03 г/моль 2) В процессе титрования раствором тиосульфата натрия 2Na2S2O3 + I2 = 2NaI + Na2S4O6
2 I2 + 2e = 2I- Согласно закону эквивалентов 𝛎 (1/6 K2Cr2O7) = 𝛎 (1/2 I2) = 𝛎 (1/1 Na2S2O3). Поэтому сразу рассчитывают нормальную концентрацию раствора Na2S2O3 по основному уравнению титриметрического анализа: C(1/1 Na2S2O3) =[C(1/6 K2Cr2O7) ∙ V(K2Cr2O7)] / V(Na2S2O3); Объем тиосульфата натрия V(Na2S2O3) – определяют по бюретке. Зная нормальную концентрацию раствора Na2S2O3 , проводят заместительное титрование других окислителей подобно K2Cr2O7. Примеры решения задач по теме «Иодометрия» Пример 1. Рассчитайте массовую долю (%) йода в образце, если навеску его массой 1.5250 г растворили в мерной колбе на 250.0 мл. На титрование 25.00 мл полученного раствора пошло 20.00 мл 0.05000 н раствора Na2S2O3. Решение: Титрование I2 раствором тиосульфата натрия протекает по уравнению: 2 Na2S2O3 + I2 = 2NaI + Na2S4O6
2 I2 + 2e = 2I- 1) Определяем молярную концентрацию эквивалента йода: С(1/2 I2) ∙ V(I2) = C(1/1 Na2S2O3) ∙ V(Na2S2O3) С(1/2 I2) = [C(1/1 Na2S2O3) ∙V(Na2S2O3)] / V(I2) = (0.0500∙20.00)/25.00 = 0.04000 моль/л 2) рассчитываем массу I2 в колбе на 250.0 мл m(I2) = С(1/2 I2) ∙ M(1/2 I2) ∙ Vколбы = 0.0400 ∙ 126.91 ∙ 0.2500 = 1.2691 г 3) массовую долю йода в образце рассчитываем по формуле w (I2) = m(I2) / m(образца) = 1.2691/1.5250 = 0.8322 или 83.22% Ответ: Массовая доля йода в образце 83.22% Пример 2. К подкисленному серной кислотой раствору иодида калия добавили 20.00 мл раствора KMnO4 с молярной концентрацией эквивалента 0.1085 моль/л. На титрование выделившегося йода пошло 23.45 мл раствора тиосульфата натрия. Вычислить молярную концентрацию эквивалента раствора тиосульфата, его титр и титр по йоду. Решение: данная задача – пример заместительного титрования. Растворы KMnO4 и Na2S2O3 ∙ 5 H2O непосредственно не реагируют друг с другом. В системе протекают следующие две реакции: 2KMnO4 + 10KI +8 H2SO4 = 5 I2 +2MnSO4+6K2SO4 +8H2O 2Na2S2O3 + I2 = 2NaI + Na2S4O6 Из закона эквивалентов следует, что: 𝛎(1/5 KMnO4) = 𝛎(1/2 I2) = 𝛎(1/1 Na2S2O3∙ 5 H2O) Это позволяет провести вычисления C(1/1 Na2S2O3 ∙ 5 H2O) по уравнению: С(1/5 KMnO4) ∙ V(KMnO4) = C(1/1 Na2S2O3 ∙ 5 H2O) ∙ V(Na2S2O3) C(1/1 Na2S2O3 ∙ 5 H2O) = [С(1/5 KMnO4) ∙ V(KMnO4)] / V(Na2S2O3) = = (0.1085∙20.00) / 23.45 = 0.09254 моль/л Титр раствора тиосульфата натрия рассчитываем по уравнению Т(Na2S2O3 ∙ 5 H2O) = [C(1/1 Na2S2O3 ∙ 5 H2O) ∙ М(1/1 Na2S2O3 ∙ 5 H2O)] /1000= (0.09254 ∙ 248.21) /1000 = 0.02297 г/мл Титр тиосульфата по йоду вычисляем по формуле Т(Na2S2O3 ∙ 5 H2O/ I2) = [C(1/1 Na2S2O3 ∙ 5 H2O) ∙ M(1/2 I2)]/1000 = = (0.09254∙126.90) /1000 = 0.01174 г/мл Ответ: C(1/1 Na2S2O3 ∙ 5 H2O) = 0.09254моль/л; Т(Na2S2O3 ∙ 5 H2O) = 0.02297 г/мл; Т(Na2S2O3 ∙ 5 H2O/ I2) = 0.01174 г/мл. 3.4.8. Уровень требований по теме «Иодометрия» В результате изучения темы «Иодометрия» студент должен: знать: сущность метода иодометрии; индикаторы метода; рабочие растворы метода; способы определения окислителей и восстановителей; уметь: готовить стандартные растворы, собирать титровальную установку, правильно проводить титрование и рассчитывать результаты анализа. владеть: современной химической терминологией в области иодометрии, навыками работы с мерной посудой, используемой в данном методе. 3.4.9. Контрольные задания 171-180 (редоксметрия) 171. а)Какой методредоксметрии называется иодометрией? Какие рабочие растворы применяются в иодометрии при определении окислителей и восстановителей? Укажите индикатор. Закончите уравнение реакции и рассчитайте молярную массу эквивалента окислителя и восстановителя SnCl2 + I2 + HCl = б)Рассчитать массу KNO2, содержащуюся в мерной колбе на 100.0 мл, если на титрование 10.00 мл KMnO4 с Т(KMnO4/ KNO2) = 0.007154 г/мл расходуется 13.50 мл нитрита калия. 172. а)Что такое редоксметрия? Для определения содержания каких веществ применяется? Закончите уравнение реакции и поясните, в каком методе редоксметрии используется данная реакция KMnO4 + KNO2 + H2SO4 = б)Навеску технического дихромата калия массой 0.1362 г растворяют в произвольном объеме воды и после обработки избытком иодида калия титруют раствором тиосульфата натрия с T(Na2S2O3)=0.001716 г/см3, расход его на титрование составляет 39.82 см3. Вычислите массовую долю (%) K2Cr2O7 в техническом образце. 173. а)Охарактеризуйте метод перманганатометрии. Является ли перманганат калия первичным стандартом? Ответ поясните. Напишите реакцию, происходящую при стандартизации раствора KMnO4 по щавелевой кислоте. Рассчитайте молярную массу эквивалента окислителя и восстановителя. б)Определить массовую долю (в %) Na2SO3 в техническом сульфите натрия, если на навеску 0.1450 г израсходовано при титровании 20.20 мл раствора йода с молярной концентрацией эквивалента C(1/2 I2) = 0.1000 моль/л. 174. а)Иодометрия и ее особенности. Приготовление стандартного раствора йода. Напишите реакцию, лежащую в основе стандартизации йода по тиосульфату натрия. Рассчитайте массу йода для приготовления 500,0 мл 0.05000 н раствора I2. б)Навеску технического железного купороса массой 5.7700 г растворили и довели до объема 250.0 мл. На титрование 25.00 мл раствора пошло в среднем 19.34 мл раствора KMnO4 с титром 0.003100 г/мл. Вычислите массовую долю (%) FeSO4 в техническом продукте. 175. а)Особенности методаперманганатометрии. Закончите уравнение реакции KMnO4 + KNO2 + H2SO4 = ……….. и рассчитайте молярную массу эквивалента окислителя и восстановителя. б)Навеска 0,2850 г технического арсенита натрия (Na2AsO3) оттитрована 27.2 см3 раствора йода (I2) с титром 0.01143 г/см3. Определить массовую долю арсенита натрия в образце. 176. а) Иодометрическое определение окислителей. Какой способ титрования при этом используется? Что служит рабочим раствором? Как его приготавливают и стандартизируют? б)Навеска 3.2240 г препарата щавелевой кислоты растворена в мерной колбе емкостью 500.0 мл. На титрование 25.00 мл этого раствора израсходовано 22.80 мл раствора KMnO4 с нормальной концентрацией С(1/5 KMnO4) = 0.1000 моль/л. Определить массовую долю H2C2O4 ∙ 2H2O в образце. 177. а)Окислительно - восстановительное титрование (редоксметрия): какие реакции лежат в его основе? Классификация методов редоксметрии. Приведите примеры определений по каждому методу с написанием соответствующих реакций. б)Навеска технического йода в 2.0000 г была растворена в колбе емкостью 2000 мл. На титрование 15.00 мл полученного раствора расходуется 24.15 мл раствора тиосульфата натрия с молярной концентрацией эквивалента C(1/1 Na2S2O3 ∙ 5 H2O) = 0.05000 моль/л. Рассчитать массу примесей в образце йода. 178. а) Иодометрическое определение восстановителей: напишите реакции, лежащие в основе их определения. Какой рабочий раствор и индикатор при этом используется? Рассчитайте массу I2 , необходимую для приготовления 250.0 мл его 0.1000 н раствора. б)3.3312 г щавелевой кислоты, содержащей 98.6% H2C2O4 ∙ 2 H2O, растворили в 200 мл воды. Какой объем этого раствора следует взять, чтобы на титрование его пошло 24.50 мл 0.1064 н раствора KMnO4? 179. а)Какой метод редоксметрии называется перманганатометрией? Почему нельзя приготовить первичный стандартный раствор KMnO4? Какие вещества используются для стандартизации раствора перманганата калия? Напишите уравнение реакции, происходящей при этом. Как устанавливается точка эквивалентности в перманганатометрии? б)Навеску дихромата калия K2Cr2O7 в 1.2000 г растворили в мерной колбе на 250.0 мл. К 25.00 мл этого раствора добавили иодид калия и серную кислоту. На титрование выделившегося йода затратили 22.86 мл раствора тиосульфата натрия Na2S2O3 . Вычислить молярную концентрацию эквивалента раствора тиосульфата натрия и его титр по йоду. 180. а)Иодометрия. Приготовление стандартного раствора тиосульфата натрия: почему нельзя приготовить раствор Na2S2O3 ∙ 5 H2O по точной навеске? Почему нормальную концентрацию и титр раствора Na2S2O3 ∙ 5 H2O устанавливают не раньше, чем через 10-15 дней после его приготовления? Напишите реакции, лежащие в основе стандартизации Na2S2O3 ∙ 5 H2O, и рассчитайте массу K2Cr2O7, необходимую для приготовления 250.0 мл его 0.1235 н раствора. б) Определите массовую долю железа (Fе2+) в соли Мора (NH4)2Fe(SO4)2 ∙ 6H2O, если 1.7825 г этой соли растворено в колбе на 100.0 см3. На титрование 10.00 см3 этого раствора пошло 9.75 см3 раствора перманганата калия с титром 0.02487 г/см3. Комплексонометрия Комплексонометрия – это метод титриметрического анализа, основанный на образовании прочных внутрикомплексных соединений (хелатов) между катионами металлов и особыми органическими реагентами – комплексонами. Метод широко используется для определения более чем 30 металлов и их катионов в различных объектах: почве, воде, удобрениях, пестицидах, сельскохозяйственных продуктах, кормах, лекарственных препаратах для животных и т.д. В настоящее время известно около 200 комплексонов. Из них наибольшее значение имеют: 1. Этилендиаминтетрауксусная кислота – ЭДТУ; комплексон II; трилон А. Она представляет собой слабую 4-х основную органическую кислоту. Её формулу сокращенно записывают H4Y. ЭДТУ мало растворима в воде (28.3 мг в 100 см3 H2O при 20оС), что затрудняет её использование в комплексонометрии. 2. Этилендиаминтетраацетат динатрия – ЭДТА; комплексон III; трилон Б. Хорошо растворяется в воде (10.8 г в 100 мл воды). ЭДТА является кислой солью ЭДТУ. Имеет следующие молекулярную и структурную формулы: C10H14O8N2Na • 2H2O (М = 372.24 г/ моль)
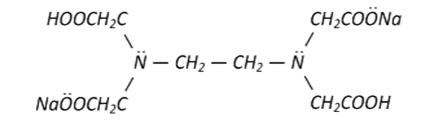
Для простоты в уравнениях реакций формулу трилона Б (ЭДТА) изображают в виде Na2H2Y или H2Y2-. Из структурной формулы ЭДТА видно, что это соединение содержит карбоксильные группы (-СООН), за счёт которых трилон Б обладает кислотными свойствами, то есть способен замещать катион водорода на катион металла. Кроме того ЭДТА содержит группы Рабочий раствор трилона Б можно приготовить тремя способами: - из фиксанала; - по точной навеске, т.е. химически чистый трилон Б является первичным стандартом; - если не уверены в чистоте реактива, то готовят раствор ЭДТА с приблизительной концентрацией с последующей стандартизацией его по первичному стандартному раствору сульфата цинка или магния. Взаимодействие между различными катионами металлов и трилоном Б, приводящее к образованию хелатов, протекает по следующим уравнениям реакций: Ме 2+ + H2Y2- ↔ MeY2- + 2H+ (1) Ме 3+ + H2Y2- ↔ MeY- + 2H+ (2) Ме 4+ + H2Y2- ↔ MeY + 2H+ (3) Внимание! Однозарядные катионы металлов Ме + с трилоном Б не взаимодействуют. Из уравнений 1-3 можно сделать вывод: катионы металлов независимо от их заряда реагируют с ЭДТА в стехиометрическом соотношении 1:1 и выделяют по два катиона водорода (2Н+). Поэтому фактор эквивалентности любого катиона металла и трилона Б в комплексонометрии равен 1/2. В качестве примера приведём структурную формулу хелата MeY2-, образованного катионами двухзарядных металлов Ме 2+:
В этом внутрикомплексном соединении Ме2+ выполняет роль комплексообразователя, ЭДТА – гексадентатного лиганда. Дентатность лиганда определяется числом химических связей, которые он образует с комплексообразователем. ЭДТА с различными катионами металлов образует бесцветные, растворимые в воде, очень прочные внутрикомплексные соединения. Каждый хелат характеризуется своей константой устойчивости (образования). Для хелата МеY2-, образованного по реакции Ме 2+ + H2Y2- ↔ MeY2- + 2H+
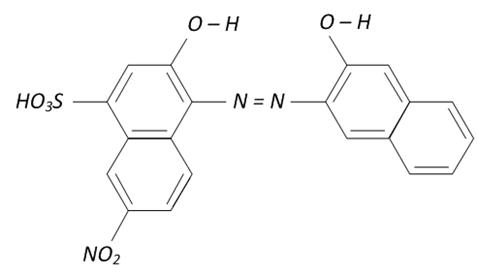
Численные значения констант устойчивости приведены в химических справочниках, например: К уст (Мg2+ - ЭДТА) = 4.9 • 108 К уст (Са2+ - ЭДТА) = 5.0 • 1010 К уст (Аl3+ - ЭДТА) = 1.1 • 1016 К уст (Zn2+ - ЭДТА) = 3.2 • 1016 Так как образование хелатов Ме –ЭДТА протекает с участием ионов водорода (смотри уравнения реакций 1-3), то при титровании катионов металлов раствором трилона Б большое значение имеет pH раствора. Установлено, что для каждого катиона существует значение рH, ниже которого титрование этого иона невозможно. Например, Аl3+ не титруется при рH < 4; Са2+ - при рH < 8; Мg2+ - при рH < 9.3; Zn2+ - при рH < 3.5. Таким образом, чем меньше константа устойчивости хелата Ме _ЭДТА, тем в более щелочной среде возможно титрование данного катиона металла. Нужное значение рH среды создается обычно с помощью буферных растворов. Кривые комплексонометрического титрования – это графические зависимости рМе от объёма добавленного титранта, где рМе = - lg C (1/2 Me n+). Величина скачка на кривой титрования зависит от исходной концентрации растворов, константы устойчивости образующегося хелата, рH cреды. Чем больше любая из этих величин, тем скачок больше. Точку эквивалентности в комплексонометрии устанавливают с помощью металлоиндикаторов. Они представляют собой органические красители, образующие окрашенные хелаты с катионами металлов, причем менее прочные, чем бесцветные хелаты металла с комплексоном, например, трилоном Б. Известно около 150 металлоиндикаторов, из которых в комплексонометрии наиболее широко применяется эриохром черный Т. Его структурная формула:
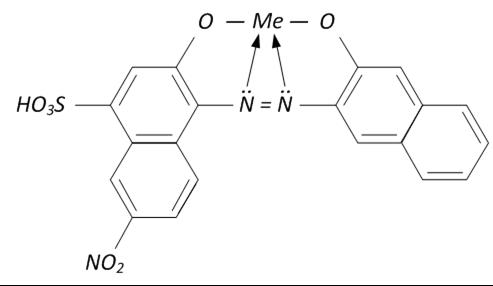
Хелат металлоиндикатора с Me2+ имеет следующий вид:
Рассмотрим сущность комплексонометрического титрования на примере 2-х зарядных катионов металлов. В раствор, содержащий Ме2+, добавляют буферный раствор (рH = 6.3-11.6) и эриохром черный Т. При этом образуются хелаты винно-красного цвета, имеющие константу устойчивости К уст1:
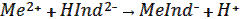
MeInd – + H2Y 2– = MeY 2– + HInd 2– + H+ винно- трилон Б, бесцвет- индикатор, красный бесцветный ный синий Обязательное условие: К уст2 > К уст1 . Вывод: комплексонометрическое титрование заканчивается при переходе винно-красной окраски раствора в синюю. Комплексонометрия – простой, быстрый и точной метод анализа. Примеры решения задач по теме «Комплексонометрия» При решении задач по комплексонометрии надо помнить, чтофактор эквивалентности трилона Б и любого катиона металла независимо от его заряда равен 1/2. Пример 1. Рассчитать титр и нормальную концентрацию циркония (II) в растворе, если при титровании 20.00 мл этого раствора с эриохромом черным Т до синей окраски пошло 10.15 мл раствора ЭДТА с молярной концентрацией эквивалента 0.1000 моль/л. Решение: Титрование Zr 2+ раствором трилона Б протекает по уравнению: Zr 2+ + H2Y2- ↔ Zr Y2- + 2H+ 1) По основному уравнению титриметрического анализа рассчитываем концентрацию циркония (II) в растворе: С (1/2 ЭДТА) ∙ V(ЭДТА) 10.15 ∙ 01000
V(Zr 2+) 20.00 2) Вычисляем титр: С(1/2 Zr 2+) ∙ М(1/2 Zr 2+) 0.05075 ∙ 45.61
1000 1000 где М(1/2 Zr 2+) = 1/2 ∙ М(Zr 2+) = 91.22/2 = 45.61 г/моль Ответ: С(1/2 Zr 2+) = 0.05075 моль/л; Т(Zr 2+) = 0.002315 г/мл Пример 2. В мерной колбе объёмом 200.0 мл растворили сульфат алюминия. На титрование 20.00 мл этого раствора пошло 20.30 мл раствора ЭДТА с нормальной концентрацией 0.05000 моль/л. Рассчитать массу алюминия в мерной колбе. Решение: Титрование Al 3+ раствором ЭДТА протекает по уравнению: Al 3+ + H2Y2- ↔ Al Y- + 2H+ 1) вычисляем молярную массу эквивалента алюминия (III): М(1/2 Al 3+) = 1/2 ∙ М (Al 3+) =26.98/2 = 13.49 г/моль 2) рассчитываем массу алюминия в колбе: С(1/2 ЭДТА) ∙ V(ЭДТА) ∙ М(1/2 Al 3+) ∙ Vколбы
V пробы ∙ 1000
0.05000 ∙ 20.30 ∙ 13.49 ∙ 200.0
20.00 ∙ 1000 Ответ: m(Al 3+) = 0.1369 г
Пример 3. К раствору соли железа (III) добавлено 20.00 мл раствора трилона Б, нормальная концентрация которого С (1/2 Na2H2Y) = 0.04520 моль/л. Избыток трилона Б оттитрован 6.05 мл раствора ZnSO4 с нормальной концентрацией С (1/2 ZnSO4) = 0.05000 моль/л. Вычислите массу железа (III) в исходном растворе. Решение: данная задача – на обратное титрование. Для решения надо записать два уравнения реакций: 1. Fe3+ + H2Y2- ↔ Fe Y- + 2H+ 2. H2Y2- (изб.) + Zn2+ ↔ Zn Y2- + 2H+ 1) по основному уравнению титриметрического анализа рассчитываем объём трилона Б, который титруется раствором ZnSO4 по реакции 2: С(1/2 ZnSO4) ∙ V(ZnSO4) 0.05000 ∙ 6,05
С(1/2 Na2H2Y) 0.04520 2) находим объём трилона Б, пошедший на взаимодействие с солью железа (III) по реакции 1: V(Na2H2Y) = V(Na2H2Y) добавл. − V(Na2H2Y)изб. = 20.00 − 6,69 = 13,31мл = =0,01331 л 3) Рассчитываем массу железа (III) в исходном растворе m (Fe3+) = С(1/2 Na2H2Y) ∙ V(Na2H2Y) ∙ М(1/2 Fe3+) = 0,04520 ∙ 0,01331∙ 27,92 = = 0,01680 г Ответ: m (Fe3+) = 0,01680 г
Лабораторная работа
|
||||||||||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 1517; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.73.248 (0.015 с.) |

 1 2S2O32- - 2e = S4O62-
1 2S2O32- - 2e = S4O62-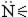 и
и 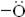 Na, за счёт которых он обладает комплексообразующими свойствами. Каждая из этих групп взаимодействует с катионом металла за счет неподелённых электронных пар на атоме азота и кислорода, образуя ковалентные связи по донорно-акцепторному механизму. Эти связи называются координационными и обозначаются стрелкой (→).
Na, за счёт которых он обладает комплексообразующими свойствами. Каждая из этих групп взаимодействует с катионом металла за счет неподелённых электронных пар на атоме азота и кислорода, образуя ковалентные связи по донорно-акцепторному механизму. Эти связи называются координационными и обозначаются стрелкой (→).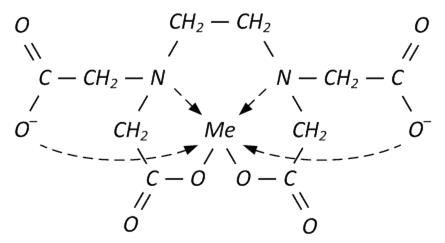
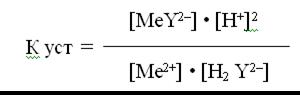

 С(1/2 Zr 2+) = = = 0.05075 моль/л
С(1/2 Zr 2+) = = = 0.05075 моль/л
 Т(Zr 2+) = = = 0.002315 г/мл
Т(Zr 2+) = = = 0.002315 г/мл  m (Al 3+) = =
m (Al 3+) = = = = 0.1369 г
= = 0.1369 г



