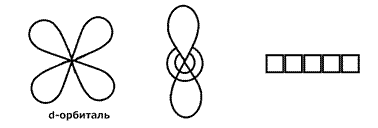Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы неорганической химииСодержание книги
Поиск на нашем сайте
1.1. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение вещества Периодический закон – это основной закон современной химии. В истории открытия и развития периодического закона можно выделить три основных этапа: 1) Первый этап: XIX век. Растет количество открытых химических элементов, определяются их атомные массы. К этому времени были известны 63 элемента, введено понятие валентность, изучены формы и свойства соединений элементов. Систематизация растущего фактического материала становилась актуальной задачей. В 1869 г. русский химик Д.И. Менделеев сформулировал открытый им закон следующим образом: «Свойства элементов, а так же форма и свойства соединений элементов находятся в периодической зависимости от величины атомной массы элементов». 2) Второй этап: НачалоXX века – революция в области физики. В 1896 г. А. Беккерель обнаруживает явление радиоактивности у соединений урана. Мария и Пьер Склодовские-Кюри обнаружили радиоактивность и у соединений тория, а в 1898 г. они открыли в составе урановых руд присутствие двух новых радиоактивных элементов – полония и радия. 1897 г. Томпсон открывает электрон и в 1903 г. создает первую модель атома «сливовый пудинг». Развивая эти представления, Э. Резерфорд в 1911г. предложил ядерную модель строения атома. В 1913 г. Мозли, изучая спектры атомов, установил, что положительный заряд ядра равен порядковому номеру элемента. В 1923 г. Д. Иваненко и В. Гейзенберг предложили протонно-нейтронную теорию строение ядер атома. Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов; массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов. Наличие изотопов позволило объяснить порядок расположения в таблице некоторых элементов: Ar – K; Te – I; Ca-Ni. Современная формулировка периодического закона – свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента. 3) 3 этап: 20-е годы XX века – Развитие квантовой механики и квантовой физики. Основоположники: Макс Планк, В. Гейзенберг, Нильс Бор, Де Броль. Еще в 1900 г. М. Планк предположил, что лучистая энергия испускается и поглощается телами не непрерывно, а дискретно. При этом, он определил энергию каждой такой порции как Е=h∙n (уравнение Планка), где n – частота излучения; h = 6,626∙10-34 Дж∙с – постоянная Планка. Де Броль показал, что электрон обладает корпускулярно-волновой двойственностью. В одних опытах он ведет себя как частица (корпускула) – имеет массу и заряд. В других – движущийся электрон проявляет волновые свойства, он способен к дифракции и интерференции. Был сформулирован принцип неопределенности Гейзенберга – невозможно одновременно точно указать местоположение и скорость движения электрона, если мы знаем, где он находится, то не знаем, с какой скоростью он движется, и наоборот. Электрон не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных точках пространства. Было введено понятие атомной орбитали. Атомная орбиталь – это часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (≈ 90%). Квантовые числа Для характеристики орбиталей используют квантовые числа: n, ℓ, m, s. 1) n – главное квантовое число, характеризующее энергию и размер орбиталей. Оно определяет число электронов на уровне N = 2n2. Принимает значения n=1,2,3,4……. ∞ – все целые числа от 1 до бесконечности. Совокупность орбиталей с одинаковым значением n – энергетический уровень, n равно номеру периода. 2) ℓ – побочное (орбитальное) квантовое число. Характеризует форму облаков и орбиталей. Принимает значения от 0 до n-1. 1) ℓ = 0. Орбиталь имеет имеет форму шара. Это s -орбиталь. Имеется на всех энергетических уровнях.
2) ℓ = 1. Орбиталь имеет имеет форму гантели.. Это p -орбиталь. Имеется на всех энергетических уровнях, кроме первого.
3) ℓ = 2. Это d - орбиталь. Появляется на третьем энергетическом уровне.
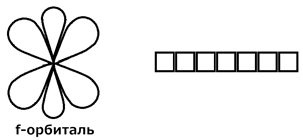
4) ℓ = 3. Это f -орбиталь. Появляется на четвертом энергетическом уровне.
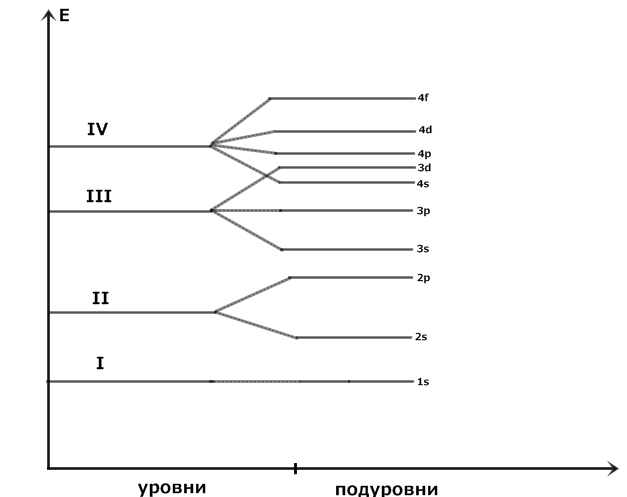
Энергетические уровни состоят из подуровней, число подуровней равно главному квантовому числу.
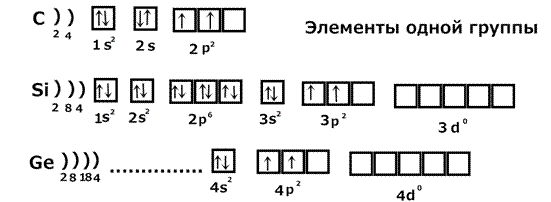
Рис. 1. Энергетическая диаграмма распределение электронов по уровням и подуровням. По величине энергии электронные уровни и подуровни располагаются в следующий ряд: 1s<2s<2p<3s<3p<4s≈3d<4p<5s<4d<5p<6s≈5d≈4f<6p<7s≈6d≈4f. 3) m – магнитное квантовое число. Характеризует направление орбиталей в пространстве и число орбиталей на подуровнях. Принимает значения от – ℓ до + ℓ (одно значение – одна квантовая ячейка.) s: ℓ =0, m=0 [_] p: ℓ =1, m= -1, 0, +1 [_|_|_] d: ℓ =2, m= -2, -1, 0, +1, +2 [_|_|_|_|_] f: ℓ =3, m= -3, -2, -1, 0, +1, +2, +3 [_|_|_|_|_|_|_] 4) S – спиновое квантовое число. Характеризует вращение электрона вокруг своей оси. Принимает 2 значения +1/2 (электрон вращается влево) и -1/2 (электрон вращается вправо). Обозначается: S=+1/2(↑), S=-1/2(↓). Правила заполнения орбиталей: 1) Принцип запрета Паули – в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковы. Поэтому на каждой орбитали может быть не более 2-х электронов с антипараллельными спинами. 2) Правило Хунда – в основном состоянии атом должен иметь максимально возможное число неспаренных электронов в пределах одного подуровня. 3) Принцип наименьшей энергии - в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной, поэтому электроны заполняют уровни в порядке возрастания их энергии 4) Правило Клечковского – прежде всего заполняются орбитали с меньшим значением суммы n + ℓ. Объяснение, почему 4s заполняется раньше, чем 3d: 4s: n=4; ℓ =0 n + ℓ = 4 3d: n =3; ℓ =2 n + ℓ = 5 Поэтому первым заполняется 4s уровень. Примеры заполнения уровней: 1) Рассмотрим заполнение уровней у элементов одной группы:
|
||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.92.58 (0.008 с.) |