
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация кислот, оснований и солей в водных растворахСодержание книги
Поиск на нашем сайте
I. Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. HCl <=>H+ + Cl- Многоосновные кислоты диссоциируют ступенчато: I ступень: II ступень: III ступень: Ка I; Ка II; Ка III называются константами диссоциации по I, II и III ступеням.
Общий ион H +, придает окраску индикаторам. II. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид - ионы ОН−. NaOH <=> Na+ + ОН − Многокислотные основания диссоциируют ступенчато: Iступень: I Iступень: I I Iступень: Где Кв I; Кв II; Кв III - константы диссоциации по I, II и III ступеням. Анионы ОН − придают окраску индикаторам. III. Соли – это электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка. Средние соли: NaCl <=> Na+ + Cl- Кислые соли: NaHSO4<=> Na+ + HSO4-; HSO4- <=> H+ + SO42- Основные соли: BaOHCl<=> BaOH++ Cl-; BaOH+ <=>Ba2++ ОН − Общих ионов нет, индикаторы не изменяют окраску. Процесс электролитической диссоциации веществ в водных растворах количественно характеризуется двумя величинами: 1. степенью электролитической диссоциации - a, 2. константой диссоциации - Кдис. I. Степень диссоциации (a) – это отношение числа молекул, распавшихся на ионы к общему числу молекул электролита. Факторы, влияющие на степень диссоциации: 1. Природа растворенного вещества, тип связи (чем полярнее связь, тем легче идет диссоциация). 2. Природа растворителя (чем больше величина диэлектрической проницаемости ε, тем легче идет диссоциация). 3. Концентрация (при разбавлении a увеличивается; a = 4. Температура (с увеличением температуры a растет до определенной величины, затем уменьшается). 5. Влияние одноименного иона (вводимый в систему одноименный ион подавляет диссоциацию слабого электролита). По величине степени диссоциации электролиты делятся на: 1. Сильные, у которых α > 30%: соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, гидроксиды щелочно-зельных металлов: кальция, стронция и бария. 2. Средние, у которых 30% < a <5%: H3PO4. 3. Слабые, у которых a <5%: H2O, HCN, NH4OH. II. Константа диссоциации (Кдис) – это константа равновесия процесса диссоциации. Рассмотрим равновесие в растворе слабого электролита. KA «K + + A - Пусть концентрация слабого электролита в растворе С моль/л, a - степень диссоциации. Тогда концентрация недиссоциированных молекул [KA]= с(1-a), а концентрация каждого из ионов [K+]=[ A-]= сa. Выражение для константы диссоциации имеет вид: Это уравнение представляет собой закон разбавления Оствальда. Оно позволяет определять степень диссоциации при разных концентрациях электролита, если известна его константа диссоциации; а также константу диссоциации электролита, если известна его степень диссоциации при какой-либо концентрации. Для растворов, в которых диссоциация электролита очень мала, a<<1, уравнение примет следующий вид: Кдис @ a2·с или a= Таким образом, степень диссоциации возрастает при разбавлении раствора.
|
||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.184.27 (0.009 с.) |

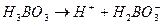 Ка I = 7.3 ×10 -10
Ка I = 7.3 ×10 -10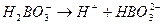 Ка II = 1.8 ×10 -13
Ка II = 1.8 ×10 -13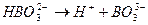 Ка III = 1.6 ×10 -14
Ка III = 1.6 ×10 -14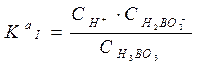 = 7.3 ×10-10;
= 7.3 ×10-10; 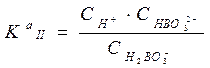 = 1.8 ×10-13
= 1.8 ×10-13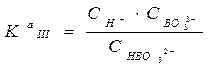 = 1.6 ×10-14
= 1.6 ×10-14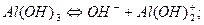
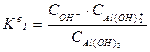 ,
,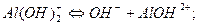
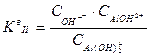 ,
,
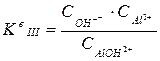 ,
, ).
).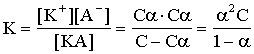
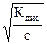 .
.


