
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила выбора индикаторов кислотно - основного титрованияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Индикаторы в методе нейтрализации представляют собой слабые органические кислоты и основания, изменяющие свою окраску в зависимости от pH раствора. Они характеризуются двумя величинами: ΔpH – интервалом перехода окраски индикатора и pT- показателем титрования индикатора (смотри таблицу 7 в разделе «Приложения»). ΔpH индикатора можно рассчитать по формуле: ΔpH = pK инд где: pK инд = - lg K инд; K инд – константа диссоциации индикатора. Показателем титрования индикатора (pT) – называется значение pH, при котором наблюдается наиболее резкое изменение окраски индикатора и заканчивается титрование. pT ≈ pK инд (3.16). Например, для метилового оранжевого: ΔpH = 3.1- 4.4; pT =4.0; для фенолфталеина: ΔpH = 8.0 - 10.0; pT =9.0. При выборе индикатора для кислотно-основного титрования необходимо придерживаться следующих правил: ΔpH – должен частично или полностью совпадать со скачком титрования; pT – должен быть внутри скачка титрования. Например, при титровании 0.1000 н раствора CH3COOH 0.1000 н раствором NaOH в качестве индикатора пригоден фенолфталеин, т.к. его рТ, равный 9, находится внутри скачка на кривой титрования.
Примеры решения задач по теме «Метод нейтрализации» Пример 1. Приготовлен рабочий раствор буры Na2B4O7 ∙ 10 H2O растворением навески массой 2.1000 г в мерной колбе объемом 100.0 мл. На титрование 10.00 мл этого раствора пошло в среднем 9.51 мл соляной кислоты. Вычислить молярную концентрацию эквивалента и титр соляной кислоты. Решение: Титрование буры раствором HCl протекает по уравнению: Nа2В4О7 + 5 Н2О + 2 HCl = 4 H3BO3 + 2 NaCl Фактор эквивалентности буры I способ (по основному уравнению титриметрического анализа): 1) Рассчитываем титр и молярную концентрацию эквивалента раствора буры: Т = m/V = 2.1000 /100.0 = 0.02100 г/мл С(1/2 Na2B4O7 ∙ 10 H2O) = (Т∙1000) / М(1/2 Na2B4O7 ∙ 10 H2O) = = (0.02100∙1000) /190.70 = 0.1101 моль/л 2) Рассчитываем молярную концентрацию эквивалента раствора HCl и ее титр: С(1/2 Na2B4O7 ∙ 10 H2O)∙V(Na2B4O7 ∙ 10 H2O) = С(1/1HCl)∙V(HCl) С(1/1HCl) = [С(1/2 Na2B4O7 ∙ 10 H2O)∙V(Na2B4O7 ∙ 10 H2O)]/ V(HCl) = = (0.1101∙10.00)/9.51 = 0.1158 моль/л Т(HCl) = С(1/1HCl)∙M(1/1 HCl)/1000 = (0.1158∙36.461)/1000 = 0.004221 г/мл II способ (через титр рабочего раствора по определяемому веществу):
1) Рассчитываем титр раствора буры по соляной кислоте: Т(Na2B4O7 ∙ 10 H2O/HCl) = [С(1/2 Na2B4O7 ∙ 10 H2O)∙ M(1/1 HCl)] /1000 = = (0.1101∙36.461) /1000 = 0.004015 г/мл 2) Рассчитываем титр HCl и молярную концентрацию эквивалента: Т(HCl) = [Т(Na2B4O7 ∙ 10 H2O/HCl)∙ V(Na2B4O7 ∙ 10 H2O)]/ V(HCl) = = (0.004015∙10.00)/9.51 = 0.004221 г/мл С(1/1HCl) = Т(HCl)∙1000/ M(1/1 HCl) = (0.004221∙1000)/ 36.461 = 0.1158 моль/л Ответ: С(1/1HCl) = 0.1158 моль/л; Т(HCl) = 0.004221 г/мл Пример 2. Рассчитать массу NaCl в пробе, если на ее титрование израсходовано 19.56 мл рабочего раствора AgNO3 с T(AgNO3/ NaCl) = 0.005680 г/мл. Чему равна нормальная концентрация раствора AgNO3? Решение: Титрование NaCl раствором AgNO3 протекает по уравнению: NaCl + AgNO3 = AgCl + Na NO3 Факторы эквивалентности всех участвующих в реакции солей равны 1/1. m(NaCl) = T(AgNO3/NaCl)∙V(AgNO3) = 0.005680∙19.56 = 0.1111 г T(AgNO3/NaCl) = С(1/1AgNO3)∙М(1/1NaCl)/1000, отсюда С(1/1AgNO3) = T(AgNO3/NaCl) ∙1000/ М(1/1NaCl) = (0.005680∙1000)/58.443 = 0.09719 моль/л Ответ: С(1/1AgNO3) = 0.09719 моль/л; m(NaCl) = 0.1111г. Пример 3. Массовая доля основного компонента (Na2B4O7 ∙ 10 H2O) в загрязненной буре определена титрованием навески массой 0.4200 г, при этом на титрование пошло 18.10 мл раствора HCl с нормальной концентрацией 0.1050 моль/л. Определить массовую долю (%) Na2B4O7 ∙ 10 H2O в образце. Решение: Титрование буры раствором HCl протекает по уравнению: Nа2В4О7 + 5 Н2О + 2 HCl = 4 H3BO3 + 2 NaCl Согласно одной из записей закона эквивалентов (3.6): m(Na2B4O7 ∙ 10 H2O) / M(1/2 Na2B4O7 ∙10 H2O) = C(1/1HCl)∙V(HCl) /1000, отсюда m(Na2B4O7 ∙ 10 H2O) = [C(1/1HCl)∙V(HCl) ∙ M(1/2 Na2B4O7 ∙ 10 H2O)]/1000 = = (0.1050∙18.10∙190.70)/1000 = 0.3624 г Массовую долю Na2B4O7 ∙ 10 H2O в образце буры рассчитывают по формуле: w (Na2B4O7 ∙ 10 H2O) = m(Na2B4O7 ∙ 10 H2O)/m(образца), w (Na2B4O7 ∙ 10 H2O) = 0.3624/0.4200 = 0.8629 (86.29%). Ответ: Массовая доля Na2B4O7 ∙ 10 H2O в образце буры 86.29%. Внимание! Во всех приведенных примерах деление на 1000 показывает перевод объема реагента из мл в литры. Лабораторная работа
|
|||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 1056; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.32.104 (2.023 с.) |

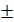 1 (3.15);
1 (3.15); Nа2В4О7 =1/2 т.к. 1 молекула буры взаимодействует с 2 Н+ от двух молекул HCl, М(Na2B4O7∙10 H2O)=381.4 г/моль.
Nа2В4О7 =1/2 т.к. 1 молекула буры взаимодействует с 2 Н+ от двух молекул HCl, М(Na2B4O7∙10 H2O)=381.4 г/моль.


