
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественные характеристики процесса гидролизаСодержание книги
Поиск на нашем сайте
Гидролиз характеризуется двумя величинами: 1. степенью гидролиза hг (%, доли единицы); 2. константой гидролиза (Кг). Обратимые реакции гидролиза, как и прочие обратимые процессы, подчиняются закону действующих масс, следовательно, для любого обратимого случая гидролиза можно записать выражение константы равновесия. Так, для реакции гидролиза NH4C1 + Н2О <=> NH4OH + HC1 Или NH4+ + Н2О <=> NH4OH + Н+ Кравн= Тогда Кг= Расчет констант гидролиза проводится по уравнениям, представленным в таблице 1. Степень гидролиза h г - это отношение концентрации соли, подвергшейся гидролизу Ссоли, к общей концентрации соли Собщ.: h г = Связь количественных характеристик процесса гидролиза Kг и hг, а также расчет рН растворов солей, подвергающихся гидролизу представлены в табл.1.
Таблица 1. Уравнения для расчета Kг; hг и рН растворов солей, подвергающихся гидролизу
Ка – константа диссоциации кислоты; С – молярная концентрация соли, моль/л; рКа – силовой показатель кислоты; Кв – константа диссоциации основания; рКв – силовой показатель основания. Факторы, влияющие на гидролиз: Гидролиз – обратимый процесс, равновесие которого можно сместить под действием некоторых факторов. 1. Разбавление – усиливает гидролиз, hг увеличивается. 2. Нагревание – усиливает гидролиз, так как гидролиз эндотермический процесс (Q<0). 3. Удаление продукта гидролиза – усиливает гидролиз, смещает равновесие вправо. 4. Добавление одного из продуктов гидролиза – подавляет гидролиз, равновесие смещается влево.
5. Чем слабее кислота или основание (чем меньше их константа диссоциации), тем сильнее протекает гидролиз. 6. Гидролиз солей, образованных слабой кислотой и слабым основанием протекает сильнее всего и не зависит от концентрации.
Пример расчета константы гидролиза солей многоосновных кислот: Na 2 CO 3 1) CO32- + HOH <=> HCO3- + OH- 2) HCO3- +HOH <=> H2CO3 + OH- Кад (НСО3-) = 5.6 ∙ 10-11; Кг = Кад (Н2СО3) = 3.5 ∙ 10-7; Кг = 10-14/3.5 ∙ 10-7= 3∙ 10-6 Сравнение констант гидролиза 1 и 2 ступени показывает, что гидролиз почти полностью протекает по первой ступени. 1.4.11. Контрольные задания 81-90 81. Содержание сульфата цинка в грунтовых водах изменилось с 0.002 до 1.75 мг/л. Как изменится рН вод при этом? Покажите расчётами. 82. Для внекорневой подкормки сосны применили раствор сульфата меди (II) с молярной концентрацией 0.001 моль/л. Будете ли контролировать среду почвенного раствора, или это не имеет значения? 83. Как изменится среда нейтрального почвенного раствора, если с оросительными водами в него попали соли кобальта (нитрата) 0.06 мг/л? 84. Анализами установлено, что в оросительных, грунтовых и дренажных водах содержание солей меди составило 0.025 мг/л и 0.007 мг/л соответственно. Рассчитайте, раствор какой соли в большей степени подкислит почвенный раствор? 85. Какова должна быть концентрация раствора хлорида аммония, если он изменяет (уменьшает) рН по сравнению с нейтральной средой на 2 единицы? 86. Покажите расчетами каким оказался эффект при внесении в солончаковую почву микроэлементов с солями ZnSО4 и MnSО4 с точки зрения состояния реакции почвенного раствора. 87. Анализом установлено, что рН почвенного раствора равен 9.3. В качестве химического мелиоранта взят раствор FeSО4. Какова должна быть молярная концентрация соли, чтобы рН уменьшить на 1? 88. Для орошения использовали воду, в которой содержится Cd2+ (в виде Сd(NO3)2); рН почвенного раствора стал 6.5. Какова молярная концентрация соли в такой воде? 89. Соли тяжелых металлов оказывают влияние на длину проростков пшеницы (уменьшают). Каков рН раствора нитрата никеля, в 100 мл которого содержится 0.02 г соли? 90. Фитотоксичность для люцерны показал никель. Так, концентрация его в сухом веществе люцерны может увеличиваться в 150 раз, при увеличении концентрации Ni(N03)2 в питательном растворе с 5 мг/л до 250 мг/л. Как изменится рН таких растворов? Покажите расчётом.
|
|||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 254; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.96.249 (0.007 с.) |

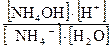 , т.к. [Н2О] = const, то Кравн. • [Н2О] = Кг
, т.к. [Н2О] = const, то Кравн. • [Н2О] = Кг 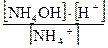
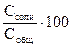 %
%
 По аниону
По аниону 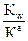
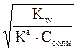 7+ 1/2 рKа + 1/2 lgCсоли
По катиону
7+ 1/2 рKа + 1/2 lgCсоли
По катиону 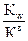
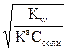 7 -1/2рKв - 1/2 lgCсоли
По
катиону и
7 -1/2рKв - 1/2 lgCсоли
По
катиону и 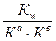
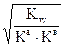 7+ 1/2 рKа -1/2рKв
аниону
7+ 1/2 рKа -1/2рKв
аниону
 Kw - ионное произведение воды =10-14
Kw - ионное произведение воды =10-14
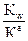 ; Кг = 10-14/5.6 ∙ 10-11= 2∙ 10-2
; Кг = 10-14/5.6 ∙ 10-11= 2∙ 10-2


