
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Kalii iodidum Калия йодид, KIСодержание книги
Поиск на нашем сайте
2) обоснуйте физико-химические свойства в соответствии с химическим строением вещества; Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса. Во влажном воздухе сыреет. Растворим в 0,75 ч. воды, в 12 ч. спирта и в 2,5 ч. глицерина
3) назовите методы определения примесей, напишите уравнения реакций для примесей, определяемых унифицированными методиками; Щелочность Недопустимые примеси: цианиды, барий, йодноватая кислота, тиосульфат, сульфит, нитраты. Примесь йодатов, тиосульфатов и сульфитов. Приб. несколько капель крахмала и разв. H2SO4. Жидкость не должна приобретать в течение 30 секунд заметного синего окрашивания. 5KI + KIO3 + 3H2SO4 à 3I2 + K2SO4 + 3H2O Синее окрашивание должно появиться при прибавлении не более одной капли 0,1 М I2. 2Na2S2O3 + I2 à 2NaI + Na2S4O6 Na2SO3 + I2 + H2O à Na2SO4 + 2HI Примесь цианидов определяют, добавляя FeSO4, FeCl3. Подщелачивают, слегка нагревают, после подкисления раствор не должен окрашиваться в синий цвет (берлинская лазурь). 2CN- + FeSO4 à Fe(CN)2 + SO42- 4CN- + Fe(CN)2 à [Fe(CN)6]4- K4[Fe(CN)6] + FeCl3 à KFe[Fe(CN)6]- + 3KCl Примесь нитратов определяют, добавляя NaOH и цинковые или железные опилки. Нагревают. Влажная красная лакмусовая бумажка в парах жидкости не должна синеть. Zn + NaOH
Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк
4) напишите уравнения реакций подлинности, указанных в нормативной документации; предложите другие методы идентификации вещества; K+ 1. Окрашивает пламя в фиолетовый цвет. 2. С раствором винной кислоты в присутствии ацетата натрия и спирта. COOH-(CHOH)2-COOH + KBr Ацетат натрия добавляют для связывания минеральных кислот. CH3COONa + H+ Этиловый спирт добавляют для уменьшения растворимость осадка. Но если спирта много, то в осадок выпадает винная кислота. Осадок растворим в минеральных кислотах: COOK-(CHOH)2-COOH¯ + HСl à COOH-(CHOH)2-COOH + KCl В щелочах (образуется синьетова соль): COOK-(CHOH)2-COOH¯ + NaOH à COONa-(CHOH)2-COOK
3. С раствором кобальтонитрита натрия, он же гексанитрокобальтат натрия выпадет желтый кристаллический осадок. 2KCl + Na3[Co(NO2)6]
I- 1. Он более сильный восстановитель, используют слабые окислители. 2KI + 2NaNO2 + 2H2SO4 àI2¯ + 2NO2 + 2Na2SO4 + K2SO4 + 2H2O 2. I- при нагревании с серной кислотой образуется йод, который обнаруживают по образованию фиолетовых паров. 8HI + H2SO4 к à H2S + 4I2 + 4H2O 3. с раствором нитрата серебра Hal- + AgNO3 AgI¯ - желтый творожистый осадок, нерастворим в растворе аммиака (10%)
5) назовите и обоснуйте метод количественного определения, указанный в нормативной документации, приведите химизм реакции, предложите альтернативные методы количественного определения вещества. Метод Фаянса – KI Точную навеску препарата предварительно высушивают, растворяют в воде, прибавляют CH3COOH, 5 капель раствора эозината натрия и титруют 0,1M AgNO3 до перехода окраски от желтой до розовой. рН – слабокислая (CH3COOH). Индикатор – адсорбционный (эозинат натрия – рис, [Ind2-](Na+)2)
KI + AgNO3 Избыток Ag: AgI¯ Метод Фольгарда – I, Обратное титрование. Титрант – 0,1M AgNO3, Ind – FeNH4(SO4)2 (железоаммонийные квасцы); pH=3 (HNO3). Избыток AgNO3 оттитровывают NH4SCN. KI + AgNO3 точн. избыток избыток AgNO3 + NH4SCN КТТ: 3NH4SCN + FeNH4(SO4)2 Преимущества: можно титровать в кислой среде, не мешают ионы. Недостатки: При определении I-, Fe3+ индикатора – окислитель. I- à I2, поэтому индикатор добавляют в последний момент.
Метод Кальтгоффа – I- в присутствии Cl, Br – йодкрахмальный метод Раствор препарата + 1 капля KIO3 + раствор крахмала и H2SO4 разв. до появления синего окрашивания. KIO3 + 5KI + 3H2SO4 Титруют AgNO3 до исчезновения синего окрашивания. KI + AgNO3 à AgI¯ + KNO3 Окислительное титрование Прямые бромато-, йодато-, перманганатометрии. Навеску растворяют в воде, прибавляют KCl разведенный и крахмал. Титруют 0,1M KBrO3 до перехода окраски из бурой через синюю до снова бурой, и, в конечном счете, в лимонно-желтую. 6KI + KBrO3 + 6HCl 3I2 + KBrO3 + 6HCl(р) à 6IСl + KBr + 3H2O (лимонно желтые) Безиндикаторная меркуриметрия для I- Титрант: Hg(NO3)2 2KI + Hg(NO3)2 2KI + HgI2¯ à K2[HgI4] f(KI) = 2 Титруют до появления неисчезающего розового осадка. КТТ: K2[HgI4] + Hg(NO3)2 à 2HgI2¯ + KNO3 (красный) Преимущества: точность, экономичность, можно титровать при сильнокислом рН. Недостатки: ядовитые соли ртути.
|
||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 573; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.237.229 (0.009 с.) |

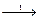 Na2ZnO2 + H2 NaNO3 + H2 à NH3 + NaOH + 2H2O
Na2ZnO2 + H2 NaNO3 + H2 à NH3 + NaOH + 2H2O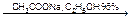 COOK-(CHOH)2-COOH¯ + HBr
COOK-(CHOH)2-COOH¯ + HBr CH3COOH + Na+
CH3COOH + Na+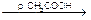 K2Na[Co(NO2)6]¯ + 2NaCl
K2Na[Co(NO2)6]¯ + 2NaCl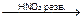 AgHal¯ + NO3-
AgHal¯ + NO3-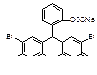
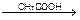 AgI¯ + KNO3
AgI¯ + KNO3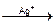 [AgI•Ag]+
[AgI•Ag]+ 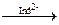 перезарядка [AgI•Ag]2Ind↓ розовое окрашивание
перезарядка [AgI•Ag]2Ind↓ розовое окрашивание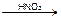 Ag I I ¯ + KNO3
Ag I I ¯ + KNO3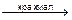 3I2 + 3K2SO4 + 3H2O
3I2 + 3K2SO4 + 3H2O


