
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фенол. Строение. Физические и химические свойства. Получение. Применение.Содержание книги
Поиск на нашем сайте К фенолам относятся производные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с бензольным ядром.
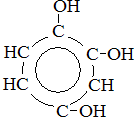
фенол 1,2-бензолдиол 1,2,4-бензолтриол Строение молекулы фенола Фенол является слабой кислотой.
Физические свойства Фенол – бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70 С растворяется в любых отношениях. Фенол ядовит! Химические свойства I. Реакции, протекающие по гидроксильной группе 1) Взаимодействие с активными металлами 2C6H5OH + 2Na à 2C6H5ONa + H2 фенолят натрия 2) Взаимодействие со щелочью C6H5OH + NaOH à C6H5ONa + H2O II. Реакции, протекающие по бензольному ядру. Реакции, протекающие по положениям 2, 4, 6. 1) Бромирование
2,4,6-трибромфенол 2) Нитрование
2,4,6-тринитрофенол или пикриновая кислота Получение C6H6 à C6H5Cl à C6H5OH
Применение: Получение лекарств, веществ для дезинфекции, фотореактивов, красителей, капрона, взрывчатых веществ, текстолита, гетинакса, карболита, стеклотекстолита, волокнита.
3. Задача № 11. Решение. Алкены присоединяют хлор и бром с образованием дигалогенпроизводных: СnH2n + Cl2 = СnH2nCl2, СnH2n + Br2 = СnH2nBr2. Бессмысленно в данной задаче пытаться найти количество дихлорида или дибромида (неизвестны их молярные массы) или количества хлора или брома (неизвестны их массы). Используем нестандартный прием: молярная масса СnH2nCl2 равна 2n + 2n + 71 = 14n + 71. М(СnH2nBr2) = 14n + 160. Массы дигалогенидов также известны. Можно найти количества полученных веществ: n(СnH2nCl2) = m/M = 11,3/(14n + 71). n(СnH2nBr2) = 20,2/(14n + 160). По условию, количество дихлорида равно количеству дибромида. Этот факт дает нам возможность составить уравнение: 11,3/(14n + 71) = 20,2/(14n + 160). Данное уравнение имеет единственное решение: n = 3. Ответ: C3H6
Билет № 12. 1. Основания. Краткая характеристика. 2. Карбоновые кислоты. Классификация. Химические и физические свойства. Уксусная кислота, применение. 3. Задача. № 12. При рентгеноскопическом исследовании организма человека применяют так называемые рентгеноконтрастные вещества. Так, перед просвечиванием желудка пациенту дают выпить суспензию труднорастворимого сульфата бария, не пропускающего рентгеновское излучение. Какие количества оксида бария и серной кислоты потребуются для получения 100 г. сульфата бария?
1. Основания. Краткая характеристика. Основания – это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. Классификация А) По числу гидроксильных групп в молекуле. Количество гидроксильных групп в молекуле основания зависит от валентности металла и определяет кислотность основания. (Следует помнить, что валентность гидроксидной группы равна I.) Основания делятся на: - Однокислотные, молекулы которых содержат одну гидроксидную группу: NaOH, KOH, LiOH и другие; - Двухкислотные, молекулы которых содержат две гидроксидные группы: Ca(OH)2, Fe(OH)2 и другие; - Трёхкислотные, молекулы которых содержат три гидроксидных группы: Ni(OH)3, Bi(OH)3 и другие; Двух- и трёхкислотные основания называются многокислотными. Б) По растворимости в воде основания делятся на: - Растворимые: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2; - Нерастворимые: Cu(OH)2, Fe(OH)2, Fe(OH)3 и другие. Растворимые в воде основания называются щелочами. В молекуле атом металла соединяется с атомами кислорода гидроксильных групп.
2. Карбоновые кислоты. Классификация. Химические и физические свойства. Уксусная кислота. Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.
– COOH – карбоксильная группа
Физические свойства Низшие карбоновые кислоты – это жидкости с острым запахом, растворимы в воде. Высшие карбоновые кислоты – твёрдые вещества без запаха, не растворимы в воде. Химические свойства 1. Диссоциация CH3COOH 2. Взаимодействие с металлами 2CH3COOH + Mg à (CH3 – CO)2Mg + H2 3. С основными и амфотерными оксидами CH3COOH + MgO à (CH3 – COO)2Mg + H2O 4. С гидроксидами CH3COOH + NaOH à CH3 – COONa + H2O 5. С солями более слабых и летучих кислот 2CH3COOH + CaCO3 à (CH3COO)2Ca + H2CO3 (разлагается на H2O и CO2 6. Получение ангидрида
ангидрит укс. кислоты 7. Со спиртами CH3 Уксусно-пентиловый эфир Получение: 1. Окисление алканов 2CH4 + 3O2 à 2H 2. Окисление спиртов C2H5OH + O2 à CH3 3. Окисление альдегидов 2CH3
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 471; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.006 с.) |







 – карбоксильная группа
– карбоксильная группа CH3COO-- + H+
CH3COO-- + H+
 + H2O
+ H2O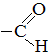 + O2 à 2CH3
+ O2 à 2CH3 


