
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предельные углеводороды (Алканы)Стр 1 из 21Следующая ⇒
Алканы – это нециклические УВ, в молекулах, которых все атомы углерода находятся в состоянии sp3- гибридизации и связаны друг с другом только σ-связями. Углеводороды с общей формулой CnH2n + 2, которые не присоединяют водород и другие элементы, называются предельнымиуглеводородами или алканами ( парафинами ). Гомологами называются вещества сходные по строению и химическим свойствам, но различающиеся по строению молекул на одну или несколько групп CH2. Химические свойства метана (CH4)
CH4 + 2O2 à CO2 + H2O + Q 2C2H6 + O2 à 4CO2 + 6H2O + Q
Задача № 1. Решение. 1. Находим количество вещества цинка, разделив его массу на молярную массу: n(Zn) = m: M = 13 г: 65 г/моль = 0,2 моль 2. Вносим эту величину в уравнение реакции и с ее помощью определяем количества всех указанных в задаче веществ (с учетом коэффициентов):
0,2 моль 0,4 моль 0,2 моль 0,2 моль Zn + 2HCl => ZnCl2 + H2
Далее расчеты по формулам: m(HCl) = M · n = 36,5 г/моль · 0,4 моль = 14,6 г m(ZnCl2) = M · n = 136 г/моль · 0,2 моль = 27,2 г Объем водорода находим аналогично: V(H2) = Vm · n = 22,4 л/моль · 0,2 моль = 4,48 л
Ответ: m(HCl) = 14,6 г; m(ZnCl2) = 27,2 г; V(H2) = 4,48 л
Билет № 2 1. Виды химических связей: ионная, металлическая, водородная, ковалентная (полярная, неполярная), одинарные и кратные связи. 2. Ненасыщенные углеводороды ряда этилена. Алкены: общая формула, состав, электронное и пространственное строение. Химические свойства этилена, применение. 3. Задача № 2. 8 г серы нагрели с 28 г железа. Определите массу продукта реакции.
1. Химические связи: Различают несколько типов химических связей: 1 – ионная. Ионная связь образуется при взаимодействии атомов, которые сильно различаются по электроотрицательности (связь между типичным металлом и типичным неметаллом).
Na0-1e = Na+ Cl0+1e = Cl— Ионная связь характерна также для щелочей и солей, в которые входят кислород и активные металлы. 2 – ковалентная связь образуется при перекрывании электронных облаков. Ковалентная неполярная образуется при взаимодействии атомов с одинаковыми электроотрицательностями.
Ковалентная полярная образуется при взаимодействии атомов, электроотрицательности которых различаются незначительно.
3 – металлическая связь образуется во всех металлах. Это связь, которую осуществляют относительно свободные электроны с положительными ионами металлов в кристаллической решётке. Атомы металла легко отдают валентные электроны и превращаются в положительные ионы. Относительно свободные электроны перемещаются между положительными ионами металла и между ними возникает металлическая связь, то есть электроны как бы цементируют положительные ионы металла в кристаллической решётке. 4 – водородная связь – это связь между атомом водорода одной молекулы и атомом сильного электроотрицательного элемента другой молекулы. 5 - водородная связь – это молекулярная связь. Она слабее, чем ионная и ковалентная связь. Простые и кратные связи Простые связи имеют элементы, у которых имеется одна связь. Кратные, – у которых имеются две, три связи. Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется простой (одинарной) связью. π- Связи – это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов. s- Облака не могут образовать π-связи. В образовании π-связей могут участвовать p- и d-облака. Например, π-связь образуется при перекрывании двух p-облаков. π-Связь образуется в тех случаях, когда между двумя атомами возникает две или три общие электронные пары. Число общих электронных пар между связанными атомами характеризует кратность связи. Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойнойсвязью. Любая двойная связь состоит из одной σ-связи и одной π-связи. Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройнойсвязью. Любая тройная связь состоит из одной σ-связи и двух π-связей. Двойные и тройные связи имеют общее название: кратные связи. 2. Непредельные углеводороды. Этиленовые углеводороды (Алкены) CnH2n
Алкены – это нециклические угдеводороды, в молекулах, которых два атома углерода находятся в состоянии sp2-гиридизации и связаны друг с другом двойной связью.
SP2-гибридизация, валентный угол = 120 l = 0,134 нм (длина связи) В молекулах этилена между атомами углерода двойная связь π и σ. σ-связь образуется гибридными облаками. σ-связь образована p-электронами (непрочная связь). Химические свойства I. Реакции присоединения 1) Гидрирование
2) Присоединение галогенов CH2 = CH2 + Br2 à CH2Br – CH2Br 1,2 дибромэтан 3) ---------------------------- CH2 = CH2 + HCl à CH3 – CH2Cl 4) Гидратация CH2 = CH2 + HOH à CH3 – CH2OH этилен этиловый спирт II. Реакции окисления: 1) Горение C2H4 + 3O2 à 2CO2 = 2H2O 2) Окисление KMnO4 – обесцвечивание розового раствора CH2 = CH2 + O + HOH à CH2OH – CH2OH этиленгликоль 3) Частичное окисление
III. Полимеризация Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счёт разрыва кратных связей, с образованием высокомолекулярного соединения полимера.
Задача № 2. Решение. 1. Так как в условии указаны массы железа и серы одновременно, то одно из этих веществ вполне может оказаться в избытке. Для выяснения этого находим количества вещества реагентов: n(Fe) = m: M = 28 г: 56 г/моль = 0,5 моль n(S) = m: M = 8 г: 32 г/моль = 0,25 моль 2. Записываем уравнение реакции и по коэффициентам определяем мольные отношения реагентов: Fe + S = FeS 3. Так как железа и серы должно реагировать равное количество молей, то ясно, что в этой реакции будет израсходовано по 0,25 моль их, избыток железа при этом составит 0,5 – 0,25 + 0,25 моль, и в реакцию не вступит. 4. Так как сера взята в недостатке, то по ее количеству определяем количество продукта реакции, а затем его массу:
0,25 моль 0,25 моль 0,25 моль Fe + S = FeS
m (FeS) = M · n = 88 г/моль · 0,25 моль = 22 г
Ответ: В ходе реакции получиться 22 г сульфида железа(II).
Билет № 3 1. Классификация химических реакций в неорганической химии. 2. Ацетилен - представитель алкинов. Химические свойства, получение и применение ацетилена в органическом синтезе. 3. Задача № 3. К раствору, содержащему 26,1 г нитрата бария, добавлен раствор, содержащий 35,5 г сульфата натрия, осадок отфильтрован. Что находится в фильтрате и в каком количестве?
|
||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 240; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.184.237 (0.016 с.) |
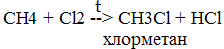


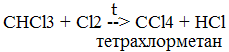

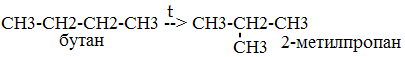



 Строение молекулы этилена C2H4
Строение молекулы этилена C2H4







