
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение: диены применяются в производстве каучуков.
Природный каучук Каучуки – природные или синтетические продукты полимеризации некоторых диеновых углеводородов с сопряженными связями. Его получают из млечного сока дерева гевея. (C5H8)n – природный изопреновый каучук. В основе природного каучука находится изопрен. Каучук – это природный полимер. Макромолекулы натурального каучука состоят из остатков молекул изопрена. Полимеризацию изопрена можно отобразить следующим образом:
Природный каучук – стереорегулярное строение (цисизомерия).
Физические свойства:
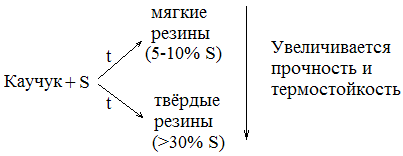
Химические свойства Вулканизация каучука: При нагревании каучука с серой происходит образование дисульфидных связей между макромолекулами каучука по месту разрыва некоторых двойных связей, при этом образуется резина («сшивание» линейных молекул). Чем больше серы, тем больше образуется дисульфидных связей. В результате этого процесса, который называется вулканизацией каучука, образуются мягкие или твёрдые резины.
Применение каучуков: шины, обувь, ткани, ленты, ремни, трубки, строительные материалы, электротехника.
3. Задача № 8. Решение. Общая формула гомологического ряда циклоалканов: СnH2n. При полном сгорании циклоалканов, как и при горении любых углеводородов, образуются углекислый газ и вода: CnH2n + 1,5n O2 = n CO2 + n H2O. В ходе реакции образовалось 336/22,4 = 15 моль углекислого газа. В реакцию вступило 112/22,4 = 5 моль углеводорода. Дальнейшие рассуждения очевидны: если на 5 моль циклоалкана образуется 15 моль CO2, то на 5 молекул углеводорода образуется 15 молекул углекислого газа, т. е., одна молекула циклоалкана дает 3 молекулы CO2. Поскольку каждая молекула оксида углерода (IV) содержит по одному атому углерода, можно сделать вывод: в одной молекуле циклоалкана содержится 3 атома углерода. Вывод: n = 3, формула циклоалкана - С3Н6. Формуле С3Н6 соответствует всего один изомер - циклопропан. Ответ: циклопропан. Билет № 9. 1. Оксиды и гидроксиды, исходя из периодической системы. 2. Газ, нефть, кокс. 3. Задача № 9. 116 г некоторого предельного альдегида нагревали длительное время с аммиачным раствором оксида серебра. В ходе реакции образовалось 432 г металлического серебра. Установите молекулярную формулу альдегида.
1. Оксиды и гидроксиды, исходя из периодической системы: рассмотрим элементы третьего периода: Na, Mg, Al, Si, P, S, Cl, Ar (аргон). Радиус атома: 0.19; 0.16; 0.143; 0.134; 0.130; 0.104; 0.099. Число электронов на внешнем слое: 1, 2, 3, 4, 5, 6, 7. Электроотрицательность: 0.9; 1.2; 1.5; 1.8; 2.1; 2.5; 3.0. Любой гидроксид содержит гидроксидные группы – OH. Слева направо: а. Радиус атомов уменьшается; б. Заряд ядра увеличивается; в. Электроотрицательность увеличивается; г. Число электронов на внешнем слое увеличивается; д. Прочность связи внешних электронов с ядром увеличивается; е. Способность атомов отдавать электроны уменьшается. Поэтому: Na, Mg, Al – металлы, а Si, P, S, Cl – неметаллы. Любой гидроксид содержит гидроксидные группы – OH. Гидроксиды могут быть основаниями (NaOH, Cu(OH)2) или кислотами (H2SO4, H3PO4). Некоторые оксиды являются амфотерными (Zn(OH)2 H2ZnO2). В зависимости от характера соответствующих гидроксидов все солеобразующие оксиды делятся на три типа: основные, кислотные, амфотерные. Основные оксиды – это оксиды, гидраты которых являются основаниями. Все основные оксиды являются оксидами металлов. Кислотные оксиды – это оксиды, гидратами которых являются кислотами. Большинство кислотных оксидов являются оксидами неметаллов. Кислотными оксидами являются также оксиды некоторых металлов с высокой валентностью (CrO3, Mn2O7). Амфотерные оксиды – это оксиды, которым соответствуют амфотерные гидроксиды. Все амфотерные оксиды являются оксидами металлов.
2. Газ, нефть, кокс. Природный газ Месторождения: Уренгойское, Заполярное, Вуктыльское, Оренбургское, Газли, Ставропольское. Основным компонентом природного газа является метан. В нём содержаться также этан, пропан, бутан. Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его содержится в природном газе.
Применение: при сгорании природного газа выделяется много теплоты, поэтому он служит энергетически эффективным и дешёвым топливом в котельных установках, доменных, мартеновских и стекловаренных печах и так далее. Природный газ – источник сырья для химической промышленности: получение ацетилена, этилена, водорода, сажи, различных пластмасс, уксусной кислоты, красителей, медикаментов и других продуктов. Нефть Нахождение: в недрах Земли на различной глубине. Если она под давлением газов, то поднимается по скважине на поверхность Земли. Физические свойства: Масляная жидкость от светло-бурого до чёрного цвета, легче воды, не растворима в ней, нет определённой температуры кипения. Состав зависит от месторождения. Фракции нефти:
Установка для перегонки нефти состоит из:
Главный недостаток перегонки – малый выход бензина (не более 20%). Крекингом называется процесс расщепления углеводородов, содержащихся в нефти, в результате которого образуются углеводороды с меньшим числом атомов углерода в молекуле. C6H14 à C8H18 + C8H16 гексадекан октан октен Пиролизом называется разложение органического вещества без доступа воздуха при высокой температуре.
Кокс
Одним из основных способов получения углеводородов (в том числе и ароматических) является коксование (пиролиз) каменного угля. При нагревании каменного угля сложные органические вещества, входящие в его состав, постепенно разлагаются с образованием летучих продуктов. Последние поступают в общий газосборник, где из них конденсируется каменная смола. Из неё путём фракционной дистилляции получают гомологи бензола, фенол и другие вещества. В газосборнике одновременно со смолой конденсируется и вода, в которой растворяются аммиак, сероводород, фенол и другие вещества. Из надсмольной воды в специальной колонне отгоняется аммиак, а затем и другие продукты. Коксовый газ охлаждают и пропускают через электрофильтры для отделения смолы. Затем из несконденсировавшегося газа извлекают аммиак и ароматические углеводороды (бензол). С целью извлечения аммиака газ пропускают через раствор серной кислоты и получают сульфат аммония – азотное удобрение. Из коксового газа выделяются водород и этилен для различных синтезов. Газ после очистки используется в качестве топлива в промышленности и быту. 3. Задача № 9. Решение. Общая формула гомологического ряда предельных альдегидов: CnH2n+1COH. Альдегиды легко окисляются до карбоновых кислот, в частности, под действием аммиачного раствора оксида серебра: CnH2n+1COH + Ag2O = CnH2n+1COOH + 2Ag. По массе выделившегося серебра можно найти количество данного металла: n(Ag) = m/M = 432/108 = 4 (моль). В соответствии с уравнением, на 1 моль альдегида образуется 2 моль серебра, следовательно, n(альдегида) = 0,5n(Ag) = 0,5*4 = 2 моль. Молярная масса альдегида = 116/2 = 58 г/моль. Дальнейшие действия попробуйте проделать самостоятельно: необходимо составить уравнение решить его и сделать выводы. Ответ: C2H5COH.
Билет № 10. 1. Предельные одноатомные спирты. Изомерия. Физические и химические свойства. 2. Водородные соединения неметаллов. 3. Задача № 10. При взаимодействии 3,1 г некоторого первичного амина с достаточным количеством HBr образуется 11,2 г соли. Установите формулу амина.
1. Предельные одноатомные спирты. Спиртами называются производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обуславливают характерные химические свойства данного класса веществ. Общая формула одноатомных спиртов: СnH2n + 1OH
Гомологический ряд CH3 – OH метанол, метиловый спирт C2H5 – OH этанол C3H7 – OH пропанол C4H9 – OH бутанол C5H11 – OH пентанол
Изомерия C4H9OH
CH3 – CH2 – CH2 – CH2 – OH 1-бутанол
Физические свойства Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют алкогольный запах. Метанол – сильный яд. Химические свойства
2C2H5OH + Na à 2C2H5ONa + H2 этанол этилат натрия
C2H5OH + HCl àC2H5Cl + H2O хлорэтан
C2H5OH à C2H4 + H2O (при t и в присутствии H2SO4)
C2H5OH + 3O2 à 2CO2 + 3H2O
этанол уксусный альдегид
уксусная кислота | этиловый спирт | укс. этиловый эфир Получение спиртов Этанол получают из: 1) Этилена C2H4 + HOH à C2H5OH (при катализаторе и t) 2) Брожением глюкозы C6H12O6 à 2C2H5OH + 2CO2 Применение этанола: получение уксусной кислоты, лекарства, фруктовых вод, духов и одеколонов, бутадиенового и бутадиен-стирольного каучука, горючего для двигателей, красителей, лаков и политур, растворителей, бездымного пороха.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 539; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.160.216 (0.039 с.) |



 2-метил 1-пропанол
2-метил 1-пропанол 2-бутанол
2-бутанол




