
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Циклопарафины. Циклоалканы. CnH2n
Циклоалканы (циклопарафины) – это насыщенные углеводороды, содержащие цикл из 3, 4, 5, 6 и более атомов углерода. Физические свойства Циклопропан и циклобутан при нормальных условиях – газы, а циклопентан и циклогексан – жидкости. Циклопарафины в воде практически не растворяются. Применение Из циклопарафинов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды – в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и так далее. Циклопропан применяется для наркоза.
3. Задача № 7. Решение. Будем действовать в соответствии с общим планом. Пусть молекула неизвестного алкина содержит n атомов углерода. Общая формула гомологического ряда CnH2n-2. Гидрирование алкинов протекает в соответствии с уравнением: CnH2n-2 + 2Н2 = CnH2n+2. Количество вступившего в реакцию водорода можно найти по формуле n = V/Vm. В данном случае n = 4,48/22,4 = 0,2 моль. Уравнение показывает, что 1 моль алкина присоединяет 2 моль водорода (напомним, что в условии задачи идет речь о полном гидрировании), следовательно, n(CnH2n-2) = 0,1 моль. По массе и количеству алкина находим его молярную массу: М(CnH2n-2) = m(масса)/n(количество) = 5,4/0,1 = 54 (г/моль). Относительная молекулярная масса алкина складывается из n атомных масс углерода и 2n-2 атомных масс водорода. Получаем уравнение: 12n + 2n - 2 = 54. Решаем линейное уравнение, получаем: n = 4. Формула алкина: C4H6. Ответ: C4H6.
Билет № 8. 1. Окислительно-восстановительные реакции (ОВР). 2. Диеновые углеводороды (Алкадиены). Природный каучук. 3. Задача № 8. При сгорании 112 л (н. у.) неизвестного циклоалкана в избытке кислорода образуется 336 л СО2. Установите структурную формулу циклоалкана.
1. Окислительно-восстановительные реакции (ОВР) -процессы, в результате которых происходит изменение степени окисления, то есть переход или смещение электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью, называют окислительно-восстановительными реакциями. ОВР – это химические реакции, при протекании которых степень окисления элементов меняется. Элемент, отдающий электроны называют восстановителем (процесс окисления). Элемент, принимающий электроны называют окислителем (процесс восстановления).
5Cu + 12HNO3 à 5Cu(NO3)2 + N2 + H2O Cu0 – 2e àCu+2 окисление (восстановитель) 5 2N+5 + 10e àN20 восстановление (окислитель) 1 2Al + Fe2O3 = 2Fe + Al2O3 (при температуре) 2. Диеновые углеводороды (Алкадиены) CnH2n-2 -это углеводороды, в молекулах которых между атомами углерода имеются две двойные связи. CH2 = CH – CH = CH2 1,3 бутадиен
Физические свойства 1,3 бутадиен – газ 2-метил-1,3 бутадиен или изопрен – жидкость Химические свойства Реакция присоединения галогенов CH2 = CH – CH = CH2 + 2Br2 à CH2Br – CHBr – CHBr – CH2Br 1,2,3,4-тетрабромбутан Получение: 1. Из этиленового спирта 2H3C – CH2OH à H2C = CH – CH = CH2 + 2H2O + H2 2. Из бутана, предельных углеводородов CH3 = CH2 – CH2 = CH3 à CH2 = CH2 – CH2 = CH2 +H2
|
|||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 270; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.151.106 (0.005 с.) |


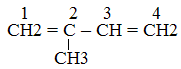 2-метил-1,3 бутадиен или изопрен
2-метил-1,3 бутадиен или изопрен (Реакция проходит при t = 4250 С и в присутствии Al2O3 и ZnO)
(Реакция проходит при t = 4250 С и в присутствии Al2O3 и ZnO)


