Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение и биологическая роль железа и его соединений
Важнейшие сплавы железа – чугун и стали – являются основными конструкционными материалами практически во всех отраслях современного производства. Хлорид железа (III) FeCl3 применяется для очистки воды. В органическом синтезе FeCl3 применяется как катализатор. Нитрат железа Fe(NO3)3 * 9H2O используют при окраске тканей. Железо является одним из важнейших микроэлементов в организме человека и животных (в организме взрослого человека содержится в виде соединений около 4 г. Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезёнке. Железо стимулирует функцию кроветворных органов.
3. Задача № 6. Решение. Пусть молекула неизвестного алкена содержит n атомов углерода. Общая формула гомологического ряда CnH2n. Алкены реагируют с бромом в соответствии с уравнением: CnH2n + Br2 = CnH2nBr2. Рассчитаем количество брома, вступившего в реакцию: M(Br2) = 160 г/моль. n(Br2) = m/M = 40/160 = 0,25 моль. Уравнение показывает, что 1 моль алкена присоединяет 1 моль брома, следовательно, n(CnH2n) = n(Br2) = 0,25 моль. Зная массу вступившего в реакцию алкена и его количество, найдем его молярную массу: М(CnH2n) = m(масса)/n(количество) = 10,5/0,25 = 42 (г/моль). Теперь уже совсем легко идентифицировать алкен: относительная молекулярная масса (42) складывается из массы n атомов углерода и 2n атомов водорода. Получаем простейшее алгебраическое уравнение: 12n + 2n = 42. Решением этого уравнения является n = 3. Формула алкена: C3H6. Ответ: C3H6.
Билет № 7. 1. Обратимость химических реакций, химическое равновесие. 2. Циклопарафины. Циклоалканы. 3. Задача. На полное гидрирование 5,4 г некоторого алкина расходуется 4,48 л водорода (н. у.) Определите молекулярную формулу данного алкина.
1. Обратимость химических реакций, химическое равновесие. Реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми. N2 + 3H2 Одну из реакций называют прямой, другую обратной. В таких реакциях концентрация реагирующих веществ уменьшается, следовательно, уменьшается скорость прямой реакции. При этом скорость обратной реакции постепенно увеличивается, наступает химическое равновесие, при котором скорость прямой реакции равна скорости обратной реакции. Это значит: сколько молекул образуется в единицу времени, столько и расходуется.
Состояние химического равновесия при неизменных условиях сохраняется длительное время. При изменении условий (t, давления (P) и концентрации (C)) состояние равновесия нарушается. Смещение химического равновесия определяется по принципу Ле Шателье: если на систему находящуюся в равновесии оказывать какое-либо воздействие, то равновесие смещается в направление ослабления этого воздействия. Если реакции идёт с выделением тепла, то при повышении t равновесие смещается в направление « [Если + Q и t Если с уменьшением объёма (V), то при повышении давления (P) равновесие смещается в направлении N2 + 3H2 1V 3V 2V всегда к меньшему объёму, если V При увеличении концентрации (C) исходных веществ равновесие смещается в сторону [Если С если увел. С прод. реакции, то если умен. С прод. реакции, то
|
|||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 172; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.163.58 (0.004 с.) |
 2NH3 + Q
2NH3 + Q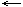 » и наоборот «
» и наоборот « ».
». , то
, то