Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соотношение неопределённости Гейзенберга. Их физический смысл.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Принцип неопределённости Гейзенбе́рга (или Га́йзенберга) в квантовой механике — фундаментальное неравенство (соотношение неопределённостей), устанавливающее предел точности одновременного определения пары характеризующих квантовую систему физических наблюдаемых (см. физическая величина), описываемых не коммутирующими операторами (например, координаты и импульса, тока и напряжения, электрического и магнитного поля). Соотношение неопределенностей] задаёт нижний предел для произведения среднеквадратичных отклонений пары квантовых наблюдаемых. Принцип неопределённости, открытый Вернером Гейзенбергом в 1927 г., является одним из краеугольных камней квантовой механики. Если имеется несколько (много) идентичных копий системы в данном состоянии, то измеренные значения координаты и импульса будут подчиняться определённому распределению вероятности — это фундаментальный постулат квантовой механики. Измеряя величину среднеквадратического отклонения
где ħ — приведённая постоянная Планка. Отметим, что это неравенство даёт несколько возможностей — состояние может быть таким, что Физический смысл соотношения неопределенностей Гейзенберга отражает тот факт, что в природе объективно не существует состояний частиц с точно определенными значениями обеих переменных x и px, y и py, z и pz. В частном случае неопределенность импульса может равняться нулю (импульс известен точно). Так будет, например, в случае плоской монохроматической волны де Бройля, характеризующей данную частицу: = h/p. Но тогда, согласно соотношению неопределенностей, x = , т.е. о месте, где будет локализована частица, ничего сказать нельзя. Частица с равной вероятностью может быть обнаружена в любой точке пространства от x = - до x = . Действительно, монохроматическая волна (волна с точно определенной длиной ) простирается от - до +. Соотношение неопределенностей может быть записано и для другой пары переменных, характеризующих состояние микрочастицы - для энергии E и времени t:
где t – время пребывания частицы в состоянии с энергией E, E - неопределенность величины энергии. Принцип запрета Паули. При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии. Принцип был сформулирован для электронов Вольфгангом Паули в 1925 г. в процессе работы над квантомеханической интерпретацией аномального эффекта Зеемана и в дальнейшем распространён на все частицы с полуцелым спином. Полное обобщённое доказательство принципа было сделано им в теореме Паули (теореме о связи спина со статистикой) в 1940 г. в рамках квантовой теории поля. Из этой теоремы следовало, что волновая функция системы фермионов является антисимметричной относительно их перестановок, поведение систем таких частиц описывается статистикой Ферми — Дирака. Принцип Паули можно сформулировать следующим образом: в пределах одной квантовой системы в данном квантовом состоянии может находиться только одна частица, состояние другой должно отличаться хотя бы одним квантовым числом. В статистической физике принцип Паули иногда формулируется в терминах чисел заполнения: в системе одинаковых частиц, описываемых антисимметричной волновой функцией, числа заполнения могут принимать лишь два значения Принцип Паули помогает объяснить разнообразные физические явления. Следствием принципа является наличие электронных оболочек в структуре атома, из чего, в свою очередь, следует разнообразие химических элементов и их соединений. Количество электронов в отдельном атоме равно количеству протонов. Так как электроны являются фермионами, принцип Паули запрещает им принимать одинаковые квантовые состояния. В итоге, все электроны не могут быть в одном квантовом состоянии с наименьшей энергией (для невозбуждённого атома), а заполняют последовательно квантовые состояния с наименьшей суммарной энергией (при этом не стоит забывать, что электроны неразличимы, и нельзя сказать, в каком именно квантовом состоянии находится данный электрон). Примером может служить невозбуждённый атом лития (Li), у которого два электрона находятся на 1S орбитали (самой низкой по энергии), при этом у них отличаются собственные моменты импульса и третий электрон не может занимать 1S орбиталь, так как будет нарушен запрет Паули. Поэтому, третий электрон занимает 2S орбиталь (следующая, низшая по энергии, орбиталь после 1S).
|
||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 3083; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.130.242 (0.006 с.) |

 координаты и среднеквадратического отклонения
координаты и среднеквадратического отклонения 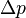 импульса, мы найдем что:
импульса, мы найдем что: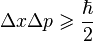 ,
,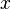 может быть измерен с высокой точностью, но тогда
может быть измерен с высокой точностью, но тогда 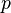 будет известен только приблизительно, или наоборот
будет известен только приблизительно, или наоборот