Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость адсорбции от концентрации адсорбтиваСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Снижение поверхностного натяжения в результате адсорбции ПАВ можно определить на основании экспериментальных измерений. Так, лимонная кислота, которая используется для пищевых целей, является ПАВ и снижает поверхностное натяжение воды (при 293 К) в зависимости от концентрации следующим образом: Концентрация лимонной кислоты, % 0 10 20 40 Поверхностное натяжение, мДж/м2 72,8 69,6 68,5 65,5 Зависимость поверхностного натяжения от концентрации ПАВ в растворе характеризует кривая 1 (рис. 5.3). Поверхностное натяжение с увеличением концентрации ПАВ снижается со значения а0, характерного для воды в отсутствие ПАВ (с = 0), до значения а при концентрации ПАВ, равной с'. Снижение поверхностного натяжения Да в результате адсорбции ПАВ на границе раздела жидкость — газ можно определить при помощи уравнения Шишковского Аа = а0 — а= dn(l + be), (5.2) где a, b — эмпирические коэффициенты. Это уравнение получено в результате обработки экспериментальных данных. Оно является аналитическим выражением изотермы поверхностного натяжения. Коэффициент а не изменя- ется в гомологическом ряду неполярного радикала молекул ПАВ. Коэффициент Ъ определяют экспериментально; его значение зависит от свойств жидкости и ПАВ. Если известны коэффициенты аи*,а также поверхностное натяжение растворителя о0, то, используя уравнение (5.2), несложно вычислить поверхностное натяжение раствора ПАВ с концентрацией с. Теория Ленгмюра и уравнение (4.34), определяющее изотерму адсорбции, применимы для адсорбции из растворов, в том числе и для адсорбции ПАВ. Используя уравнение Ленгмюра и уравнение Гиббса (4.18), можно пояснить значение коэффициентов а и b в уравнении Шишковского (5.2). Для этого, принимая во внимание условие (4.3), приравняем правые части уравнений (4.18) и (4.34):
с da RT dc °° Разделим переменные: -da = Г RT bde (5.4) Проинтегрируем правые и левые части равенства (5.4) при Т = const: bde
fda=-r RT f Учитывая, что d(l + be) — d(bc), после интегрирования уравнения (5.5) получим be). (5.6) Обозначим через а произведение ТкЯТ, тогда Г^а/RT. (5.7) Подставив равенство (5.7) в формулу (5.6), получим уравнение Шишковского, которое соответствует формуле (5.2). Коэффициенты а и b этого уравнения, которые ранее рассматривались как эмпирические, теперь приобретают определенный физический смысл. В соответствии с равенством (5.7) коэффициент а определяет предельную адсорбцию, а коэффициент Ь, согласно уравнению (4.29), — равновесный характер адсорбции и является константой равновесия.
Кроме уравнения (5.2), снижение поверхностного натяжения в результате адсорбции можно определить при помощи уравнения Фрумкина Рис. 5.3. Зависимость поверхостного натяжения (1) и Адсорбции (2) от концентрации Адсорбтива
Да = а0 - а = - Л77Чп(1 - Г/TJ. (5.8) Если уравнение Шишковского (5.2) связывает поверхностное натяжение с концентрацией адсорбтива, а уравнение Ленгмюра (4.34) — адсорбцию с концентрацией, то уравнение Фрумкина определяет изменение поверхностного натяжения в зависимости от адсорбции. Фундаментальное уравнение Гиббса (4.18) связывает все параметры, которые характеризуют адсорбцию (а, с, Г) Предельная адсорбция Величину Г^ которая согласно условию (4.3) равна А^ входящую в уравнение Ленгмюра (4.34), называют предельной адсорбцией. Увеличение концентрации ПАВ приводит к росту адсорбции, но после достижения определенной концентрации ПАВ адсорбция перестанет возрастать и будет оставаться постоянной, так как поверхностный слой целиком заполнен. Это есть предельная адсорбция — адсорбция в момент образования монослоя адсорбата, состоящего из молекул ПАВ. По значению предельной адсорбции Г^ можно определить параметры адсорбционного слоя: Во — площадь, занимаемую одной молекулой ПАВ, и 5 — толщину адсорбционного слоя (см. рис. 5.2, б). Если обозначить число молекул насыщенного адсорбционного слоя площадью 1м2 через ято, то площадь, занимаемая одной молекулой, будет определяться по формуле Во = Х/п^ = 1/(/jVa), (5.9) где NA — число Авогадро. Зная плотность растворенного вещества р и его молекулярную массу М, можно рассчитать толщину предельного адсорбционного слоя, которая будет соответствовать длине молекул (вследствие вертикальной ориентации молекул в мономолекулярном слое). Произведение Г^М эквивалентно массе адсорбата на 1 м2: моль/м2кг/моль = кг/м2 Эту же массу можно выразить через произведение 5р(м • кг/м3 = кг/м2), т.е. = 5р; 5 = Г^М/р. (5.10) Таким образом, предельная адсорбция позволяет определить размеры молекул ПАВ в насыщенном адсорбционном слое. Предельная адсорбция определяет площадь, занимаемую гидрофильной частью молекул ПАВ, которая не зависит от длины углеводородного радикала, т.е. гидрофобной части молекулы. Так, например, гидрофильная часть алифатических спиртов определяется гидроксильной группой ОН, и их предельная адсорбция (выраженная в молях
на м2) будет одинакова/В соответствии с уравнением (5.9) площадь в адсорбционном слое одной молекулы всех спиртов будет также одинакова и равна 0,25 нм2, или 0,25 • 10~18 м2. Для всех жирных кислот (например, уксусной, пропионовой, масляной, валериановой, капроновой, гептановой), несмотря на различие углеводородной части, площадь поперечного сечения молекул в адсорбционном насыщенном слое составляет 0,20 нм2, или 0,20 • 10~18 м2. По значению предельной адсорбции с помощью уравнений (5.9) и (5.10) в 1919 г. коллоидно-химическими методами впервые удалось определить размеры молекул. По мере развития науки размеры молекул стали определять другими методами, результаты которых подтвердили достоверность полученных ранее данных. Предельную адсорбцию Гж, которая является важнейшей характеристикой мономолекулярной адсорбции, можно определить графическим путем. Для этой цели уравнение (4.34) представляют в следующем виде:
\ + Ьс
(5.11)
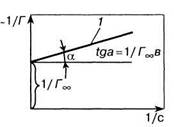
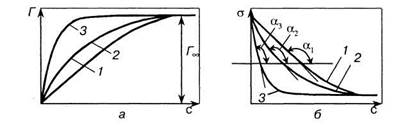
Ть + г (5.12) В координатах «1/Т— 1/с» уравнение (5.12) описывается прямой (линия 1 на рис. 5.4). Тангенс угла наклона этой прямой есть величина, обратная предельной адсорбции, т.е. tga = \/FJb. Отрезок, отсекаемый на оси ординат, характеризует величину \/Гх, первое слагаемое правой части уравнения (5.12), т.е. величину, обратную предельной адсорбции, что позволяет найти предельную адсорбцию /\ По тангенсу угла наклона прямой 1 можно определить значение FJb, а по ранее известной 1/Гж — численное значение константы Ь. Так, например, рассчитанные по описанному выше методу значения предельной адсорбции для гексилового СН3(СН2)4СН ОН и гептилового СН3(СН2)5СН2ОН спиртов совпадают и равны 1- 10~~5 моль/м2. Таким образом, по изотерме адсорбции Г =f(c) можно определить не только значение предельной адсорбции, но и константу b уравнения Ленгмюра [уравнение (4.34)]. В соответствии с уравнением (4.29) b характеризует константу равновесия процессов адсорбции и десорбции, когда адсорбция не достигла предельного значения, а снижение поверхностного натяжения определяется поверхностной активностью g [см. формулу (5.1) и рис. 5.1]. Иными словами, константа равновесия адсорбционного процесса связана с поверхностной активностью g. Рассмотрим рис. 5.5. На рис. 5.5, а изображены изотермы адсорбции, а на рис. 5.5, б показано снижение поверхностного натяжения по мере увеличения концентрации пропилового С3Н7ОН (кривая 1), бутилового С4Н9ОН (кривая 2) и пентилового С5НПОН (кривая 3) спиртов. Поверхностная активность g в соответствии с формулой (5.1) есть производная функции da/dc при с —> 0 и определяется тангенсом угла наклона кривых /, 2 и 3. Поверхностная активность различных спиртов неодинакова; из рис. 5.5, б следует, что —tga3 > —tga2 > —tga,, (da/dc)3 > (da/dc)2 ,; g3 > g2> (5.13)
Рис. 5.4. Графическое
определение Г. [к уравнению (15.12)]
Условие (5.13) означает, что с увеличением длины углеводородного радикала, характеризующего гидрофобную часть молекулы ПАВ, поверхностная активность увеличивается. Чем больше величина поверхностной активности, тем круче изотерма адсорбции (сравним кривые 1 и 3 на рис. 5.5, а) и быстрее достигается предельная адсорбция. Поверхностная активность зависит от длины углеводородного радикала, и согласно эмпирическому правилу Траубе-Дюкло при удлинении углеводородного радикала на одно звено (группу) СН2 поверхностная активность увеличивается примерно в 3—3,5 раза. Это правило соблюдается для водных растворов некоторых ПАВ при небольшой длине углеводородного радикала и комнатной температуре. Константа Ь, входящая в уравнение (4.34), увеличивается (как и поверхностная активность) примерно в 3—3,5 раза при удлинении на одну группу СН2 углеводородной части молекул ПАВ данного гомологического ряда. Константа b для гексилового спирта С6Н13ОН равна 1,1 • 10~3, а для гептилового С7Н15ОН — 3,3 • 10~3, т.е. увеличивается в 3,3 раза при удлинении углеводородной цепи на одну группу СН2; в данном случае соблюдается правило Дюкло-Траубе. Гидрофобные взаимодействия Термин «гидрофобные взаимодействия» был предложен Лен-гмюром еще в 1916 г. при выводе уравнения изотермы мономолекулярной адсорбции. Они возникают только в водных растворах в результате взаимодействия полярных молекул воды с неполярными гидрофобными частицами, молекулами (углеводородами) или неполярными радикалами молекул, в частности неполярными радикалами молекул ПАВ.
|
||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 1125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.011 с.) |


 Г Г„Ъс Г ГЬс ГЪс
Г Г„Ъс Г ГЬс ГЪс