
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Измерение электропроводности растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электропроводность раствора определяют, измеряя активное сопротивление между погруженными в него электродами. Для измерения сопротивления пользуются переменным током звуковой частоты (1000 Гц), т. к. постоянный ток вызывает разложение раствора и поляризацию электродов. Сопротивление раствора электролита определяют путем сравнения его сопротивления с эталонным сопротивлением. Для этого используют мостик Уитстона (рис. 16). Сопротивления R1, R2, R3, RX подбирают так, чтобы, ток в диагонали мостика отсутствовал, т. е. сопротивление его ветвей было пропорционально друг другу. Измеряемое сопротивление RX можно найти по формуле.
Сопротивления R1, и R2 выбирают постоянными или сохраняют постоянным их соотношение; R3 может изменяться. При балансировке моста регулируют сопротивление R3 и находят сопротивление RX. Ошибки, связанные с поляризационными явлениями, уменьшаются с повышением частоты тока и увеличением концентрации. При частоте тока выше 1000 Гц влияние поляризации незначительно.
Высокочастотное титрование 3.4.1. Теоретические основы и общие положения теории высокочастотного титрования Это вариант бесконтактного кондуктометрического метода, в котором при количественном анализе раствор подвергается действию электрического поля высокой частоты (более 3 МГц). В электрическом поле переменной частоты, ионы в растворе колеблются относительно точки равновесия. При увеличении частоты амплитуда колебаний уменьшается и, наконец, наступает момент, когда ионы становятся неподвижными. При этом под действием высокочастотного поля возникает деформация, в результате чего происходит деформационная поляризация молекул и ионов раствора. Кроме этого возникает ориентационная поляризация за счет вращения деформированных молекул и ионов вокруг своей оси в электрическом поле.
lпол = lакт + Зависимость полной электропроводности от состава исследуемого раствора сложна и не однозначна. Форма кривых титрования может изменяться и зависит от концентрации (рис. 17 а) и частоты (рис. 17 б). Поэтому часто вместо прямого высокочастотного анализа используется высокочастотное титрование. Часто в точке эквивалентности образуется не излом, а плавный изгиб. В этом случае её находят путем продолжения прямолинейных участков полученной кривой. Высокочастотное титрование применяют в анализах, основанных на использовании реакций нейтрализации, окисления - восстановления, осаждения, комплексообразования. Метод удобен, если реакцию проводят в герметической аппаратуре (ампулы), когда контакт электродов с раствором недопустим, при работе с окрашенными и темными растворами, при образовании осадков и титровании взвесей и эмульсий. Анализ осуществим при концентрации растворов от 10-5 до нескольких молей. Недостатком метода является его малая избирательность, проведению анализа мешают все посторонние ионы, находящиеся в растворе. В высокочастотном титровании используют два типа ячеек:
б) Индуктивные ячейки (рис. 18 б) – применяются обычно для исследования сильных электролитов. Стеклянный стакан с исследуемым раствором вставляется внутрь индуктивной катушки. В ячейках такого типа измеряют индуктивность и электропроводность раствора.
Потенциометрия Потенциометрический метод анализа основан на измерении ЭДС потенциометрической ячейки, которая состоит из двух электродов.
Второй, индикаторный электрод – его равновесный потенциал обратимо изменяется при изменении концентрации ионов, находящихся в растворе, или при протекании химических реакций. Ионы, от концентрации которых зависит потенциал данного электрода, называются потенциал определяющими. В зависимости от способа протекания электродного процесса электроды можно разделить на две группы: I – классические электроды, в которых потенциал определяется наличием какой-либо окислительно-восстановительной системы, 2 – мембранные (ионоселективные) электроды, потенциал которых, возникший между разными поверхностями мембраны, обусловлен неравномерным распределением ионов по разные стороны мембраны.
Классические электроды Окислительно-восстановительная система, определяющая потенциал электрода в растворе может: · состоять из компонентов, находящихся в растворе (платиновый электрод); · возникать при погружении электродов в раствор (металлические электроды І и ІІ рода). Платиновый электрод Электрод - инертный металл (Pt), погружённый в раствор, в котором присутствует окислительно-восстановительная система (например, Fe3+/Fe2+). При этом, электрод не принимает участие в ОВР, а служит для передачи электронов от восстановителя к окислителю. Fe3+ + Потенциал такого электрода описывается уравнением Нернста:
при Т= (273+25) К, для разбавленных растворов
где E 0 – равновесный потенциал, при [ Ok ] = [ Boccт ]
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 861; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.228.79 (0.008 с.) |

 RX=
RX= 
 Наличие этих двух типов поляризации приводит к перемещению заряда в растворе, при неподвижности самих ионов (эстафетный эффект). При этом в растворе возникают кратковременные токи, которые изменяют его электропроводность и диэлектрическую проницаемость. Измеренная в этих условиях полная электропроводность представляет собой сумму активной составляющей (истинная электропроводность) и реактивной составляющей (мнимая электропроводность) (1), которая зависит от частоты поля и типа ячейки:
Наличие этих двух типов поляризации приводит к перемещению заряда в растворе, при неподвижности самих ионов (эстафетный эффект). При этом в растворе возникают кратковременные токи, которые изменяют его электропроводность и диэлектрическую проницаемость. Измеренная в этих условиях полная электропроводность представляет собой сумму активной составляющей (истинная электропроводность) и реактивной составляющей (мнимая электропроводность) (1), которая зависит от частоты поля и типа ячейки: lреакт (1)
lреакт (1) а) Ёкостные ячейки (рис. 18 а) – применяются обычно для исследования слабых электролитов и представляют собой кольцо, в которое вставляется стеклянный стакан с исследуемым раствором. Ячейка представляет собой конденсатор, обкладками которого являются электрод и раствор электролита, а диэлектриком стенки стакана. В ячейках такого типа измеряют ёмкостный ток, который зависит от ёмкости и электропроводности раствора.
а) Ёкостные ячейки (рис. 18 а) – применяются обычно для исследования слабых электролитов и представляют собой кольцо, в которое вставляется стеклянный стакан с исследуемым раствором. Ячейка представляет собой конденсатор, обкладками которого являются электрод и раствор электролита, а диэлектриком стенки стакана. В ячейках такого типа измеряют ёмкостный ток, который зависит от ёмкости и электропроводности раствора.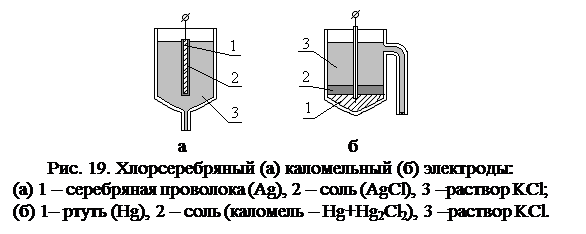 Один электрод – электрод сравнения, его потенциал остаётся постоянным при протекании химических реакций и при изменении концентрации ионов, находящихся в растворе. Часто в качестве электрода сравнения используют хлорсеребряный и каломельный электроды (рис. 19).
Один электрод – электрод сравнения, его потенциал остаётся постоянным при протекании химических реакций и при изменении концентрации ионов, находящихся в растворе. Часто в качестве электрода сравнения используют хлорсеребряный и каломельный электроды (рис. 19). ↔ Fe2+
↔ Fe2+




