
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электроды с жесткими мембранамиСодержание книги
Поиск на нашем сайте
I группа. Мембрана представляет собой пористый материал, пропитанный органической жидкостью, не смешивающейся с водой. Эта жидкость насыщена не растворимой солью определяемого иона, которая хорошо растворима в органических растворителях и практически не растворима в воде. При этом мембрана способна обратимо обмениваться определяемым ионом с водным раствором, т.е. определяемый ион способен обратимо десорбироваться с поверхности мембраны, таким образом возникает заряд, обусловленный оставшимися в органическом растворителе противоионами. Чем ниже концентрация определяемого иона в растворе, – тем активнее протекает процесс десорбции его с поверхности мембраны и тем выше заряд на поверхности мембраны и наоборот. Пример: Кальций-селективный электрод. Жидкая мембрана разделяет внутренний и внешний растворы, причём концентрация внутреннего раствора неизменна. Во внутренний и внешний растворы помещены индифферентные электроды сравнения или Pt-электроды. Жидкая мембрана, насыщена солью Са2+ с двузамещённым сложным эфиром додецилортофосфорной кислоты. На поверхности мембраны протекает обратимый процесс диссоциации этой соли:
Чем ниже концентрация Са2+ в растворе, тем активнее будет протекать процесс десорбции ионов Са2+ с поверхности мембраны и тем больше будет величина отрицательного заряда поверхности мембраны за счет оставшихся в ней анионов эфира фосфорной кислоты и тем меньше будет величина граничного потенциала на поверхности мембраны и наоборот. При погружении неполяризуемых электродов по разные стороны мембраны можно измерить величину трансмембранного потенциала. Он представляет собой разность граничных потенциалов по разные стороны мембраны. Величина мембранного потенциала описывается уравнением Нернста:
Конструктивно электрод выполнен так, что концентрация ионов Са2+ во внутреннем растворе постоянна, т.е.
II группа: Мембрана представляет собой пористый материал, пропитанный органической жидкостью, не смешивающейся с водой в которой растворен индифферентный, незаряженный переносчик определяемого иона. Это комплексон, образующий с определенными ионами устойчивые комплексы. Пример: Калий-селективный валиномициновый электрод. Валиномицин (циклооктадепсипептид) – комплексообразователь, он комплексует ионы К+ и переносит их по градиенту концентраций: Val + K+ ↔ [Val K]+, анион при этом остается с той стороны мембраны, где концентрация ионов К+ больше (рис. 25). В результате этого образуется трансмембранный потенциал, Этот потенциал препятствует дальнейшему переходу ионов К+ по градиенту концентрации, таким образом процесс останавливается в состоянии равновесия. Чем больше разница между концентрациями ионов К+ по разные стороны мембраны, тем больше будет величина трансмембранного потенциала. При погружении электродов по разные стороны мембраны можно измерить величину этого потенциала, которая описывается уравнением Нернста:
Конструктивно электрод выполнен так, что концентрация ионов K+ во внутреннем растворе постоянна, т.е.
3.5.3. Способы определения ЭДС Для определения ЭДС используют потенциометрическую ячейку, которая состоит из индикаторного электрода и электрода сравнения. Существуют 2 метода измерения ЭДС ячейки: 1. Некомпенсационный метод. В этом случае измеряют электрический ток, протекающий через ячейку который пропорционален величине ЭДС. Метод неточен, поскольку при протекании большого тока происходят поляризационные процессы на электродах, которые изменяют величину потенциала. Кроме того, ток будет изменяться в зависимости от величины сопротивления раствора. Этот метод применим только для измерения ЭДС мембранных ионоселективных электродов, обладающих сопротивлением 107-109 Ом. 2. Компенсационный метод (метод Поггендорфа).
Передвигая движок реохорда, добиваются такого положения, чтобы гальванометр показал ноль. В этом случае ток через потенциометрическую ячейку не идёт, поскольку значение ЭДС потенциометрической ячейки будет компенсировано потенциалом, установленным на реохорде. Для определения ЭДС ячейки измеряют падение напряжения на реохорде или рассчитывают его из соотношения длин плеч реохорда:
где ЕН – ЭДСнормального гальванического элемента Вестона (ЕН = 1,0186 В при 20 °С; ЕХ – ЭДС неизвестного гальванического элемента.
Методы потенциометрии Прямая потенциометрия. В данном методе используют только ионоселективные электроды. Суть метода заключается в том, что используется серия стандартных растворов исследуемого вещества, либо калибруют шкалу потенциометра, либо, измеряя потенциалы стандартных растворов строят калибровочный график в координатах Е - С. Метод добавок. Метод можно использовать как в прямой потенциометрии, так и при потенциометрическом титровании В данном методе используются 2 раствора: I – стандартный, с известными Vст и Сст II – исследуемый, с известным Vx и неизвестной Сх Сначала измеряют потенциал, исследуемого раствора Сх исходя из уравнения Нернста:
± Затем к известному объёму, исследуемого вещества Vx прибавляют известный объём Vст – стандартного раствора с концентрацией Сст, после чего определяют его потенциал. Е2= Е0 ±
Решая совместно уравнения (1) и (2), находим концентрацию исследуемого раствора:
3) Потенциометрическое титрование. Метод подразумевают любой потенциометрический способ определения концентрации, использующий добавление титранта к исследуемому раствору. При этом после каждого добавления титранта измеряется потенциал индикаторного электрода. Изменение потенциала будет увеличиваться по мере приближения к точке эквивалентности. Кривые потенциометрического титрования имеют характерный вид (рис. 27)
Преимуществом потенциометрического титрования перед обычным титрование является высокая точность, отсутствие субъективности, возможность титрования окрашенных и мутных растворов, возможность определения нескольких веществ без их предварительного разделения. Метод можно использовать и при отсутствии ионоселективных электродов, расширение круга электродов, используемых для определения концентрации Сх, нивелирует влияние примесей. Метод осаждения. В данном методе нет универсальных индикаторных электродов. В качестве индикаторного электрода используется электрод, потенциал которого зависит от концентрации одного из ионов, участвующих в реакции осаждения. В качестве электродов сравнения используют хлорсеребряный или каломельный электрод. Пример: определение ионов Ag+ титрованием раствора AgNO3 100 мл 0,1 н раствора NaCl. AgNO3 + NaCl = AgCl¯ + NaNO3 Пусть объём AgNO3 равен 100 мл; концентрация AgNO3 10-1 моль/л. Для титрования используется серебряный электрод. Рассчитаем кривую титрования по уравнению Нернста. При титровании по методу осаждения величину потенциала рассчитывают, подставляя в уравнение Нернста концентрацию, потенциал определяющего иона, т.е. концентрация потенциал определяющего иона рассчитывается по убыли (избытку) в растворе титрования. 1) Исходный раствор AgNO3, VNaCl = 0
2) До Т.Э. добавим VNaCl =90 мл, следовательно осталось 10% Ag+, т.е. СAg+ = 0,01моль/л
3) Точка эквивалентности Концентрация потенциал определяющего иона в точке эквивалентности рассчитывается из величины ПР данного осадка
4) После точки эквивалентности. В этом случае концентрация потенциалопределяющего иона рассчитывается по избытку титранта, Прибавим 0,1 % избыток NaCl (0,1 мл). Учитывая исходную концентрацию NaCl – 0,1 моль/л, при 0,1 % избытке NaCl – в растворе [Сl-] = 10 -4моль/л. Из выражения ПРAgCl:
По методу осаждения можно определить несколько компонентов находящихся в растворе одновременно. При этом для того чтобы наблюдалось насколько скачков на кривой титрования необходимо чтобы ПР образующихся осадков различались не менее чем на 3 порядка, т.е.:
Причём, в начале титрования выпадает осадок с меньшим значением ПР, затем остальные осадки по мере увеличения ПР.
Сначала будет протекать реакция:
После полного выпадения будет протекать реакция:
Кривая титрования имеет вид рис. 29.
Метод нейтрализации. В качестве индикаторного используется стеклянный или водородный электрод. В близи Т.Э. на кривой титрования наблюдается скачёк рН, который будет тем большим, чем больше константа диссоциации (Кд) реагирующих веществ и чем выше их концентрации. При Кд<10-9 и при очень низких концентрациях реагентов скачёк на кривой практически отсутствует, однако точку эквивалентности можно определить с помощью метода Грана. Суть метода Грана При выполнении условия:
Знак минус ставится, в случае избытка титранта. Кривые титрования до и после точки эквивалентности спрямляются в координатах: (VX + V)·10 ± pH – V, где VХ – объём титруемого вещества; V – объём титранта.
Метод Грана применим также при использовании метода добавок. При этом к известному объёму исследуемого раствора (VX) добавляется несколько объемов стандартного раствора исследуемого вещества и после каждого добавления измеряют потенциал. Затем строят графическую зависимость в координатах: (VX + V)·10 ± pH – V,
Согласно закону эквивалентов: где V – объем порции добавленного стандартного раствора. СХ · VХ = CСТ · |Vэкв| Метод Грана применим не только в методе нейтрализации, но и в других методах потенциометрического титрования. При титровании по методу нейтрализации многоосновных кислот или многокислотных оснований; или смеси кислот или оснований на кривой титрования наблюдаются несколько скачков, если константы диссоциации веществ отличаются не менее, чем на 4 порядка, т.е.:
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 231; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.93.61 (0.007 с.) |

 ,
, причем анионы эфира фосфорной кислоты остаются внутри мембраны (рис. 24)
причем анионы эфира фосфорной кислоты остаются внутри мембраны (рис. 24)
 =const. Отсюда потенциал Са-селективного электрода равен:
=const. Отсюда потенциал Са-селективного электрода равен:
 образуемый ионами К+ с той стороны мембраны где их концентрация меньше и противоионами с другой стороны мембраны.
образуемый ионами К+ с той стороны мембраны где их концентрация меньше и противоионами с другой стороны мембраны.
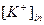 =const. Отсюда потенциал K-селективного электрода зависит только от концентрации ионов К+ во внешнем растворе и равен:
=const. Отсюда потенциал K-селективного электрода зависит только от концентрации ионов К+ во внешнем растворе и равен:
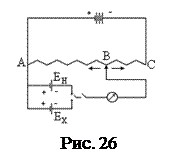 Схема установки для определения ЭДС изображена на рис. 26. Метод основан на измерении разности потенциалов ячейки при компенсации её ЭДС внешним источником тока.
Схема установки для определения ЭДС изображена на рис. 26. Метод основан на измерении разности потенциалов ячейки при компенсации её ЭДС внешним источником тока.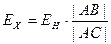
 , отсюда:
, отсюда: (1)
(1) , отсюда:
, отсюда: , (2)
, (2)
 При потенциометрическом титровании часто используют метод добавок, когда исследуемый раствор титруют стандартным раствором этого же вещества.
При потенциометрическом титровании часто используют метод добавок, когда исследуемый раствор титруют стандартным раствором этого же вещества.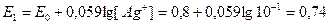 В
В В
В =10-10, т.к. VAgNO
=10-10, т.к. VAgNO  =VNaCl, то
=VNaCl, то  , отсюда:
, отсюда: моль/л
моль/л В
В моль/л
моль/л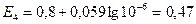 В
В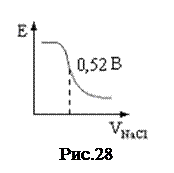 Кривая титрования имеет вид рис. 28. Кривая в обратную сторону представляет собой титрование ионов Cl- ионами Ag+.Величина скачка тем больше, чем меньше величина ПРосадка и чем выше концентрация, реагирующих веществ. Изгиб на кривой титрования отчетливо виден при ПРосадка< 10-8. В противном случае при анализе полученных данных используют метод Грана (см. метод нейтрализации).
Кривая титрования имеет вид рис. 28. Кривая в обратную сторону представляет собой титрование ионов Cl- ионами Ag+.Величина скачка тем больше, чем меньше величина ПРосадка и чем выше концентрация, реагирующих веществ. Изгиб на кривой титрования отчетливо виден при ПРосадка< 10-8. В противном случае при анализе полученных данных используют метод Грана (см. метод нейтрализации). 10± 3
10± 3 Пример: определение NaCl и NaI при совместном присутствии в растворе с помощью серебряного электрода.
Пример: определение NaCl и NaI при совместном присутствии в растворе с помощью серебряного электрода.

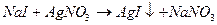

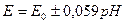
 Построенные прямые пересекают ось абсцисс в точке эквивалентности (рис. 30). При этом можно использовать ветвь кривой, полученной по результатам, как до, так и после точки эквивалентности. Вблизи точки эквивалентности ход кривых нарушается.
Построенные прямые пересекают ось абсцисс в точке эквивалентности (рис. 30). При этом можно использовать ветвь кривой, полученной по результатам, как до, так и после точки эквивалентности. Вблизи точки эквивалентности ход кривых нарушается. Полученная спрямляющая прямая пересекает ось абсцисс в отрицательной области (рис. 31), а точка её пересечения с абсциссой соответствует эквивалентному объёму. Эквивалентный объём стандартного раствора содержит такое же количество исследуемого вещества, как и взятый исходный объём анализируемого вещества.
Полученная спрямляющая прямая пересекает ось абсцисс в отрицательной области (рис. 31), а точка её пересечения с абсциссой соответствует эквивалентному объёму. Эквивалентный объём стандартного раствора содержит такое же количество исследуемого вещества, как и взятый исходный объём анализируемого вещества. 10 ± 4
10 ± 4


