
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация методов анализа
1. Электрохимические методы; 2. Оптические методы; 3. Спектроскопия ЭПМР; 4. Спектроскопия ЯМР; 5. Рентгеноструктурный анализ; 6. Хроматография; 7. Масспектрометрия; 8. Нейтронный активационный анализ.
Электрохимические методы анализа 1) Кондуктометрия; 2) Потенциометрия; 3) Полярография; 4) Вольтамперометрия Кондуктометрия Теоретические основы
Кондуктометрия – метод анализа, основанный на измерении электропроводности растворов. Электропроводностью раствора (W) – называют его способность проводить электрический ток, при наличии электрического поля, и обусловленною направленным движением ионов в электрическом поле. W, [Cм; Ом -1]
W= W=æ Удельная электропроводность (æ) – представляет собой электропроводность раствора находящегося между 2-мя параллельными электродами площадью 1см2 расположенными на расстоянии 1 см. æ, [См · см-1] æ= Эквивалентная электропроводность (l) – это электропроводность раствора содержащего 1 моль (1 г-экв) электролита в 1 см3 раствора. Численно она равна отношению удельной электропроводности к молей вещества в 1 мл. l, [См·см2·моль-1] l= j, [моль ∕мл] Если воспользоваться эквивалентной молярной (нормальной) концентрацией [моль/л], то l имеет вид: l=
Предельная эквивалентная электропроводность Пусть имеются два электрода, с площадью сечения 1см2, находящиеся на расстоянии 1см друг от друга. Обозначим абсолютные скорости движения ионов между электродами в этом случае, при разности потенциалов равной 1 В, как V + и V-, тогда при разности потенциалов равной U и расстоянии между электродами равному l, абсолютные скорости будут равны: Для катионов: (6) Для анионов: Ток, который проходит через поперечное сечение S, за одну секунду, при этих условиях равен: I= Так как, исходя из закона Ома: W= то электропроводности (W, æ, l) равны: W= Так как S и l равны 1 æ= l= a·F·(V+ + V-) (11) Величина в 96500 раз (число Фарадея [Кл/моль]) больше, чем абсолютные скорости движения ионов называется подвижностью ионов в растворе и обозначается l + и l - Для катионов: l + =F·V+ (12) Для анионов: l -=F·V- l=a·(l + + l -) (13) При уменьшении концентрации степень диссоциации увеличивается и при бесконечном разбавлении (С®0, a®1) l стремится принять максимальное значение, которое называется – предельной эквивалентной электропроводностью при бесконечном разбавлении.
Согласно закону Кольрауша: l0 = (l0 + + l0 -) (14) Величины подвижностей ионов являются константами и приведены в таблицах. Они включают в себя величины зарядов ионов, поэтому можно сравнивать величины подвижностей ионов с различными зарядами.
|
|||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 216; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.0.25 (0.054 с.) |
 (1)
(1)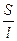 (2)
(2) (3)
(3) (4)
(4) (5)
(5)

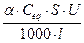 F·(V+ + V-) (7)
F·(V+ + V-) (7) (8)
(8) F·(V+ + V-) (9)
F·(V+ + V-) (9) F·(V+ + V-), (10)
F·(V+ + V-), (10)


