
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние различных факторов на электропроводностьСодержание книги
Поиск на нашем сайте
Электропроводность зависит от числа переносчиков заряда и от скорости их движения.
Влияние природы электролита и растворителя Чем выше степень диссоциации электролита, тем больше переносчиков заряда, и тем выше электропроводность электролита, при данных условиях. Величина a зависит от диэлектрической проницаемости раствора e, чем выше e, тем на больших расстояниях проявляются меж ионные взаимодействия, и тем выше a и следовательно l. Электропроводность зависит от подвижности ионов. Аномально высокой подвижностью обладают ионы Н+ (l0н+= 350) и гидроксильные ионы ОН- (l0он-= 198). Это объясняется эстафетным эффектом переноса. Все остальные ионы имеют l0 в пределах от 50 до 80. Чем выше вязкость растворителя, тем ниже подвижность ионов, и тем следовательно ниже электропроводность раствора.
Влияние концентрации электролита а) Сильные электролиты – в воде практически полностью диссоциируют (a=1).
При увеличении С уменьшается l. Для сильных электролитов l = lmax, при С®0. При малых концентрациях (С £ 100 ммоль/л) зависимость l от С описывается эмпирическим уравнением прямой:
Отношение величины l при данной С к предельной l0 называется коэффициентом электропроводности.
¦l= тогда: l=¦l·(l0 + - l0 -) (16) æ=
б) Слабые электролиты в растворе имеют не высоки концентрации ионов, поэтому ¦l=1. Отсюда: l=a·¦l·(l0 ++ l0 -) (18) при разведении раствора l увеличивается. æ= при увеличении С слабого электролита æ увеличивается незначительно, а затем плавно уменьшается, т. к. снижается степень диссоциации (рис.2, в). Влияние температуры С увеличением Т уменьшается вязкость раствора, это приводит к увеличению подвижности ионов и a, и увеличению электропроводности. Зависимость æ от температуры выражают уравнением: æt = æ0·(1+αt+βt2) (20) где æ0 - удельная электропроводность раствора при 0 °С; α и β - коэффициенты, зависящие от концентрации и природы электролита. Повышение температуры на 1 град вызывает увеличение электропроводности раствора на 2-2,5%.
Методы кондуктометрического анализа Прямая кондуктометрия Концентрация электролита определяется по электропроводности раствора, которая в определенных пределах прямо пропорциональна концентрации с помощью калибровочного графика [æ=¦(С)]. Метод используется для определения индивидуальных электролитов в растворе и электролитов в смесях, когда концентрации примесей не изменяются и невысоки. Метод применяется для контроля качества воды, осадков и органических препаратов, определения влажности сыпучих материалов.
|
||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.178.162 (0.008 с.) |

 При увеличении концентрации удельная электропроводность вначале увеличиваются, за счет увеличения числа переносчиков заряда. Дальнейшее увеличение С приводит к уменьшению расстояния между ионами, что приводит к увеличению меж ионных взаимодействий. Меж ионные взаимодействия тормозят движение ионов, т.е. снижается их подвижность, что приводит к уменьшению æ (рис.2, а и б).
При увеличении концентрации удельная электропроводность вначале увеличиваются, за счет увеличения числа переносчиков заряда. Дальнейшее увеличение С приводит к уменьшению расстояния между ионами, что приводит к увеличению меж ионных взаимодействий. Меж ионные взаимодействия тормозят движение ионов, т.е. снижается их подвижность, что приводит к уменьшению æ (рис.2, а и б).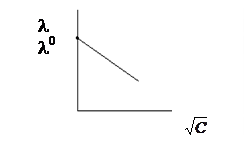

 (15)
(15) ·(l0 ++ l0 -) (17)
·(l0 ++ l0 -) (17) ·(l0 ++ l0 -) (19)
·(l0 ++ l0 -) (19)


