
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика полярографического анализа. ⇐ ПредыдущаяСтр 10 из 10
Для анализа какого-нибудь вещества полярографическим методом его прежде всего переводят в раствор. Потом создают необходимую среду и удаляют примеси, которые мешают определению. Большие неудобства для полярографирования создают вещества с потенциалами, близкими к потенциалу восстановления исследуемого элемента или с потенциалами более низкими, чем потенциал восстановления исследуемого элемента. Мешает определению и растворенный кислород. Для удаления веществ, которые мешают, широко применяют: осаждение, комплексообразование, окисление-восстановление. Для удаления растворенного кислорода, который восстанавливается на катоде, через раствор пропускают водород. В щелочные растворы прибавляют Na2SO3. Большое значение так же имеет правильный выбор фона для полярографирования. Обычно его подбирают опытным путем. Подготовленный к анализу раствор, свободный от посторонних примесей, помещают в электролизёр (рис. 6.2). Включают постоянный электрический ток и постепенно повышают напряжение. При непрерывном увеличении напряжения регистрируют изменение силы тока. На основании полученных данных строят полярографическую кривую. Для количественных определений в полярографии применяют метод калиброванных кривых, метод стандарта или метод добавок. При применении метода калибровочных кривых снимают полярограммы стандартных образцов. По высоте волны h и концентрации С0 строят калибровочную кривую. По высоте волны неизвестного образца определяют его концентрацию по калибровочной кривой. В методе стандарта снимают полярограмму только одного стандартного раствора и рассчитывают концентрацию неизвестного раствора по формуле:
В методе добавок в электролизёр наливают определенный объем исследуемого вещества с неизвестной концентрацией (СА) и получают его волну hА. Потом прибавляют к раствору 1-3 млстандартного раствора исследуемого вещества с известной концентрацией (ССТ) и снова снимают полярограмму. Получают суммарную волну h ОБЩ. Неизвестную концентрацию (мг/мол) вычисляют по формуле:
где h ОБЩ – высота волны исследуемого вещества после добавления стандартного раствора; ССТ – концентрация иона (вещества), который добавляется, в электролизер.
где V СТ - объем стандартного раствора добавляемого в электролизер, мл; VА - объем исследуемого раствора в электролизере, мл; ССТ - начальная концентрация стандартного раствора.
Полярографы. Для полярографического анализа применяют полярографы. Они бывают визуальные и автоматические. Последние позволяют отсчитывать силу тока и напряжение не только визуально, но и по кривой зависимости силы тока от напряжения, автоматически записываемой специальным прибором. Схема полярографа показана на рис. 6.3. С помощью внешнего источника тока 1 (батареи аккумуляторов на 4-6 В ) напряжение подается на реохорд 2. Напряжение на реохорде измеряется вольтметром 3.
Пример. Определение цинка в растворе методом стандарта. В мерную колбу объем которой 50 млпомещают 10 млраствора ZnSO4 ([Zn2+] – С1=0,5 мг/мл ), 20 капель раствора желатина и доводят до метки 1 н. раствором KCl. Полученный раствор тщательно перемешивают. 20-25 млэтого раствора помещают в электролизер и пропускают через раствор водород в течение 20 мин.Затем раствор полярографируют (при соответствующем положении шунта), строят график и определяют высоту волны h 1. К раствору ZnSO4 неизвестной концентрации, в колбе объемом 50 мл, прибавляют 20 капель раствора желатина и доводят объем до метки 1 н. раствором КС1. Подготовленный раствор наливают в электролизер, пропускают через него водород в течение 20 мин,снимают полярограмму, строят график и определяют высоту волны (h). Концентрацию ионов Zn2+ (СX)находят по формуле (мг/мл ):
где Сх = 0,5· Содержание цинка в растворе в миллиграммах вычисляют, как произведение концентрации Сх на объем мерной колбы (50 мл).
Конец конспекта!
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 403; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.8.110 (0.005 с.) |
 (6.2)
(6.2)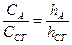
 (6.3)
(6.3) (6.4)
(6.4)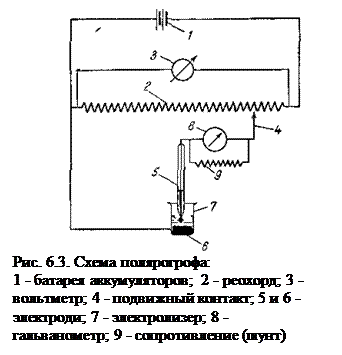 Постепенным передвижением подвижного контакта 4(вправо по шкале реохорда) увеличивают напряжение на электродах 5, 6 (5 – капельный ртутный катод, опущенный в анализируемый раствор, 6 – ртуть, налитая на дно электролизера 7). Сила тока, который возникает при этом в цепи, измеряется с помощью чувствительного гальванометра 8. Так как при одной и той же чувствительности гальванометра нельзя снимать полярограммы в растворах разных концентраций, то параллельно гальванометру подключают градуированное сопротивление (шунт) 9. При низкой концентрации исследуемого раствора возникает также и небольшой ток. В этом случае шунт включают полностью, чтобы практически весь ток проходил через гальванометр. При больших концентрациях растворов сопротивление шунта уменьшают, и через гальванометр проходит только часть тока.
Постепенным передвижением подвижного контакта 4(вправо по шкале реохорда) увеличивают напряжение на электродах 5, 6 (5 – капельный ртутный катод, опущенный в анализируемый раствор, 6 – ртуть, налитая на дно электролизера 7). Сила тока, который возникает при этом в цепи, измеряется с помощью чувствительного гальванометра 8. Так как при одной и той же чувствительности гальванометра нельзя снимать полярограммы в растворах разных концентраций, то параллельно гальванометру подключают градуированное сопротивление (шунт) 9. При низкой концентрации исследуемого раствора возникает также и небольшой ток. В этом случае шунт включают полностью, чтобы практически весь ток проходил через гальванометр. При больших концентрациях растворов сопротивление шунта уменьшают, и через гальванометр проходит только часть тока.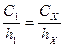 (6.5)
(6.5) = 0,1 мг/мл.
= 0,1 мг/мл.


