
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. Титрование слабой кислоты сильным основанием и наоборот.
а) титрование слабой кислоты CH3COOH сильным основанием NaOH (рис.10). CH3COOH+NaOH = H2O + CH3COONa CH3COOH+Na++OH- = H2O+CH3COO- +Na+ l0H+ / l
После точки эквивалентности W еще больше возрастает, за счет добавления сильного электролита. Вблизи точки эквивалентности ход кривой искажается за счет гидролиза образующейся соли, до и после точки эквивалентности гидролиз подавляется избытком титруемого вещества и титранта. Удовлетворительный результат, при титровании кислот и оснований, наблюдается, если их константы диссоциации ≥5·10-7. б) титрование сильного основания NaOH слабой кислотой CH3COOH(рис. 11). NaOH + CH3COOH = H2O + CH3COONa Na+ + OH- + CH3COOH = H2O+ CH3COO- +Na+
При титровании до точки эквивалентности электропроводность уменьшается W↓, за счет замены высокоподвижных ионов ОН- менее подвижными ионами СН3СОО-. После точки эквивалентности W = const, поскольку добавление слабой кислоты не приводит к изменению числа ионов СН3СОО-, так как диссоциация CH3COOH подавляется наличием иона CH3COO-. Вблизи точки эквивалентности ход кривой искажается за счет гидролиза образующейся соли, до и после точки эквивалентности гидролиз подавляется избытком титруемого вещества и титранта.
III. Титрование слабой кислоты слабым основанием и наоборот (рис. 12). СH3COOH + NH4OH = CH3COONH4 + H2O СH3COOH + NH4OH = CH3COO - + NH4+ + H2O
После точки эквивалентности добавление слабого электролита не будет приводить к изменению электропроводности W (диссоциация NH4OH будет подавляться наличием в растворе соли, вблизи точки эквивалентности W будет несколько снижаться, из-за гидролиза соли CH3COONH4).
Метод комплексонометрии I. Комплексон не является кислотой, в процессе титрования не выделяется Н+, а образующийся комплекс представляет заряженную частицу.
В этом случае комплексон является либо неэлектролитом, либо слабым электролитом. Пример: 18-краун-6 (рис. 13).
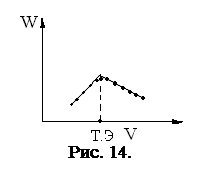
В результате комплексообразования до точки эквивалентности электропроводность раствора обычно возрастает из-за увеличения радиуса образующегося комплексного иона, что приводит к снижению степени его гидратации и увеличению подвижности. После точки эквивалентности добавление слабого электролита не приводит к изменению W. Пример: если добавляемый комплексон является громоздкой структурой, то образующееся комплексное соединение может обладать меньшей подвижностью, чем определяемый ион и поэтому до точки эквивалентности электропроводность раствора уменьшается, а после точки эквивалентности остаётся неизменной. II. Комплексоны – слабые органические кислоты, в процессе титрования выделяют Н+, образующийся комплекс не заряжен. Пример: a) титрование в водном растворе (рис. 14). Ca2+ +Na2[H2ЭДТА] = Na2[Ca ЭДТА]+ 2H+ (1)
До точки эквивалентности электропроводность увеличивается W за счет появления вместо Ca2+ (l Титрование необходимо проводить без добавления больших количеств кислот или оснований. Пример: б) титрование в буферном растворе: NH4OH-NH4Cl – аммиачный буфер (рис. 15). Сa2+ + Na2[H2ЭДТА] = Na2[CaЭДТА] + 2H+ (I) 2H+ + 2NH4OH = 2H2O + 2NH4+ (II)
После точки эквивалентности при избытке титранта электропроводность раствора увеличивается более сильно.
Наличие в растворе буфера, один компонент которого является сильным электролитом, приводит к загрублению результатов анализа, поэтому буферные растворы следует использовать в невысоких концентрациях (0,05-0,1 моль/л).
|
||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 413; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.81.214 (0.01 с.) |
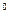 Na+ = 8; a CH
Na+ = 8; a CH  COONa / aCH
COONa / aCH 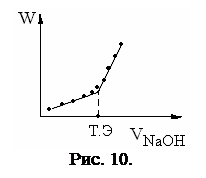 Несмотря на то, что в результате титрования, ионы Н+ заменяются менее подвижными ионами Na+ электропроводность до точки эквивалентности возрастает W↑, так как в результате реакции образуется вместо слабого электролита – кислоты (CH3COOH) сильный электролит – соль CH3COONa.
Несмотря на то, что в результате титрования, ионы Н+ заменяются менее подвижными ионами Na+ электропроводность до точки эквивалентности возрастает W↑, так как в результате реакции образуется вместо слабого электролита – кислоты (CH3COOH) сильный электролит – соль CH3COONa.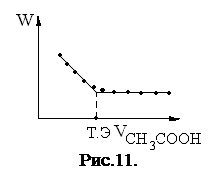 lОН
lОН  = 198,3; l CH
= 198,3; l CH 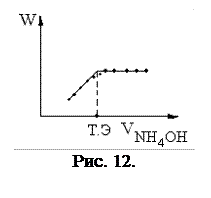 До точки эквивалентности электропроводность растет, поскольку в процессе титрования вместо слабой кислоты появляется сильный электролит – соль. Гидролиз соли при этом будет подавляться избытком титруемого вещества.
До точки эквивалентности электропроводность растет, поскольку в процессе титрования вместо слабой кислоты появляется сильный электролит – соль. Гидролиз соли при этом будет подавляться избытком титруемого вещества.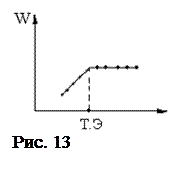
 Na2[CaЭДТА] + 2H+ + Na2[H2ЭДТА] = Na 2[Ca ЭДТА] + H4ЭДТА + 2Na+ (2)
Na2[CaЭДТА] + 2H+ + Na2[H2ЭДТА] = Na 2[Ca ЭДТА] + H4ЭДТА + 2Na+ (2) =59,6) эквивалентного количества ионов Н+ (1), обладающих большей подвижностью (l
=59,6) эквивалентного количества ионов Н+ (1), обладающих большей подвижностью (l  =349,8). После точки эквивалентности добавление избытка титранта – натриевой соли слабой кислоты приведет к образованию слабой кислоты (H4ЭДТА) в протонированном виде (2), вместо Н+ будет появляться эквивалентное количество Na+, обладающих меньшей подвижностью l0Na
=349,8). После точки эквивалентности добавление избытка титранта – натриевой соли слабой кислоты приведет к образованию слабой кислоты (H4ЭДТА) в протонированном виде (2), вместо Н+ будет появляться эквивалентное количество Na+, обладающих меньшей подвижностью l0Na 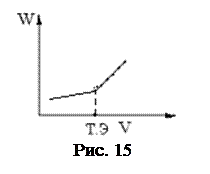 При добавлении титранта до точки эквивалентности идут две реакции: (I) – образование комплекса Ca2+ с трилоном Б; (II) – взаимодействие ионов Н+ с NH4OH входящим в аммиачный буфер. Электропроводность немного увеличивается, т.к. l
При добавлении титранта до точки эквивалентности идут две реакции: (I) – образование комплекса Ca2+ с трилоном Б; (II) – взаимодействие ионов Н+ с NH4OH входящим в аммиачный буфер. Электропроводность немного увеличивается, т.к. l 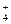 =73,6
=73,6


