Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние рН на скорость ферментативной реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
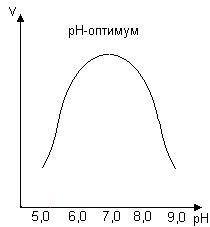
График зависимости ферментативной активности от рН представлен на рис. 33.
Рис. 33. Влияние рН на скорость ферментативной реакции
График зависимости от рН имеет колоколообразную форму. Значение рН, при котором активность фермента максимальна, называется рН-оптимумом фермента. Значения рН-оптимума для различных ферментов колеблются в широких пределах.
Характер зависимости ферментативной реакции от рН определяется тем, что этот показатель оказывает влияние на: a) ионизацию аминокислотных остатков, участвующих в катализе, b) ионизацию субстрата, c) конформацию фермента и его активного центра.
22.Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (схема Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат. Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+. Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот. Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
Витамин РР входит в состав кофермента НАД+ и НАДФ+, который принимает участие в ферментативных реакциях по последовательному механизму. Две ферментативные реакции, катализируемые ферментами Е1 и Е2, сопряжены друг с другом посредством кофермента NAD+, служащего в каждом из этих случаев субстратом. Для первого фермента субстратом служит окисленная форма NAD, в качестве второго субстрата выступает донор водорода - пример последовательных реакций, продуктом - восстановленная форма NAD, для фермента Е2 - наоборот.
Витамин В5 – принимает участие в синтезе кофермента А (Ацетил-КоА). Кофермент А (КоА) — кофермент ацетилирования; один из важнейших коферментов; принимает участие в реакциях переноса ацильных групп. Молекула КоА состоит из остатка адениловой кислоты, связанной пирофосфатной группой с остаткомпантотеновой кислоты, соединённой пептидной связью с остатком β-меркаптоэтаноламина. С КоА связан ряд биохимических реакций, лежащих в основе окисления и синтеза жирных кислот, биосинтеза жиров, окислительных превращений продуктов распада углеводов. Во всех случаях КоА действует в качестве промежуточного звена, связывающего и переносящего кислотные остатки на другие вещества. При этом кислотные остатки в составе соединения с КоА подвергаются тем или иным превращениям, либо передаются без изменений на определённые метаболиты. Витамин В2 – принимает участие в формировании кофактора ФАД и ФМН. Флавинадениндинуклеотид — кофактор, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования вмитохондрии. Молекула FADH2 окисляется в FAD, при этом выделяется энергия, эквивалентная (запасаемая в форме) двум молям ATФ.
23. Активация ферментов (частичный протеолиз, восстановление тиоловых групп, удаление ингибиторов). Понятие об активаторах, механизм их действия. Из 25 24. Ингибиторы ферментов. Типы ингибирования. Лекарственные препараты – ингибиторы ферментов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Следует отметить, что все денатурирующие агенты также вызывают уменьшение скорости любой ферментативной реакции, вследствие неспецифической денатурации белковой молекулы, поэтому денатурирующие агенты к ингибиторам не относят. В основе действия многих лекарственных препаратов и ядов лежит ингибирование активности ферментов, поэтому знание механизмов этого процесса крайне важно для молекулярной фармакологии и токсикологии. Ингибиторы способны взаимодействовать с ферментами с разной степенью прочности. На основании этого различают обратимое и необратимое ингибирование. По механизму действия ингибиторы подразделяют на конкурентные и неконкурентные. Обратимое ингибирование Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. Конкурентное ингибирование К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. В этом случае с ферментом взаимодействует либо субстрат, либо ингибитор, образуя комплексы фермент-субстрат (ES) или фермент-ингибитор (EI). При формировании комплекса фермента и ингибитора (EI) продукт реакции не образуется. Для конкурентного типа ингибирования справедливы следующие уравнения: Е + S ⇔ ES → E + P, E + I ⇔ EI.
Лекарственные препараты как конкурентные ингибиторы Многие лекарственные препараты оказывают своё терапевтическое действие по механизму конкурентного ингибирования. Например, четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту. При добавлении ингибиторов активность ацетилхолинэстеразы уменьшается, концентрация ацетилхолина (субстрата) увеличивается, что сопровождается усилением проведения нервного импульса. Ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Эффективные антихолинэстеразные препараты - прозерин, эндрофоний и др. Неконкурентное ингибирование Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Неконкурентный ингибитор может связываться либо с ферментом, либо с фермент-субстратным комплексом, образуя неактивный комплекс. Присоединение неконкурентного ингибитора вызывает изменение конформации молекулы фермента таким образом, что нарушается взаимодействие субстрата с активным центром фермента, что приводит к снижению скорости ферментативной реакции.
Необратимое ингибирование Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+), которые в малых концентрациях блокируют сульфгидрильные группы активного центра. Субстрат при этом не может подвергаться химическому превращению. При наличии реактиваторов ферментативная функция восстанавливается. В больших концентрациях ионы тяжёлых металлов вызывают денатурацию белковой молекулы фермента, т.е. приводят к полной инактивации фермента. Необратимые ингибиторы ферментов как лекарственные препараты. Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - широко используемый препарат аспирин. Противовоспалительный нестероидный препарат аспирин обеспечивает фармакологическое действие за счёт ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты. В результате химической реакции ацетильный остаток аспирина присоединяется к свободной концевой NH2-группе одной из субъединиц циклооксигеназы. Это вызывает снижение образования продуктов реакции простагландинов, которые обладают широким спектром биологических функций, в том числе являются медиаторами воспаления.
25. Регуляция действия ферментов: аллостерические ингибиторы и активаторы, каталитический и регуляторный центры. Регуляция активности ферментов по типу обратной связи, путем фосфорилирования и дефосфорилирования.
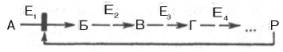
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:
Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, накопление которого выше допустимого уровня оказывает мощное инги-бирующее действие на первую стадию процесса и соответственно на фермент E1. Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру. Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конфор-мационные изменения, наблюдаемые при присоединении субстрата и эффекторов. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса). Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости v от [ S ] в присутствии модулятора обусловлен эффектом кооперативности. Это означает, что связывание одной молекулы субстрата облегчает связывание второй молекулы в активном центре, способствуя тем самым увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрации субстрата. Химическая модификация фермента. Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации. Оказалось, что активность ряда ключевых ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорили-рования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами. Уровень активности ключевых ферментов обмена углеводов и соответственно интенсивность и направленность самих процессов обмена определяются соотношением фосфорилированных и дефосфорилированных форм этих ферментов. Обычно различают обратимую ковалентную и нековалентную химические модификации ферментов, осуществляемые через ОН-группысерина, реже – тирозина или за счет нековалентных взаимодействий с молекулой фермента. В первом случае активным ферментомоказывается или фосфорилированная, или дефосфорилированная форма, как в случае с молекулами мышечной фосфорилазы и гликогенсинтазы соответственно). В качестве примеров можно в виде схемы представить оба типа модификации, в которой символом Р обозначается остаток фосфата, Pi– неорганический фосфат (Н3РО4), РРi – неорганический пирофосфат (Н4Р2О7),АМФ – остаток адениловой кислоты. Химическая постсинтетическая модификация ферментов включает, кроме того, процессы ограниченного протеолиза,метилирования, гликозилирования, уридилирования, аденилирования, АДФ-рибозилирования и др., обеспечивая тем самым микроскопический тип регуляции активности ферментов и соответственно физиологическую скорость процессов обмена веществ.
Общим фундаментальным механизмом, посредством которого реализуются биологические эффекты «вторичных» мессенджеров внутри клетки, является процесс фосфорилирования – дефосфорилирования белков при участии широкого разнообразия протеинкиназ, катализирующих транспорт концевой группы от АТФ на ОН-группы серина и треонина, а в ряде случаев – тирозина белков-мишеней. Процесс фосфорилирования представляет собой важнейшую посттрансляционную химическую модификацию белковых молекул, коренным образом изменяющую как их структуру, так и функции. В частности, он вызывает изменение структурных свойств (ассоциацию или диссоциацию составляющих субъединиц), активирование или ингибирование их каталитических свойств, в конечном итоге определяя скорость химических реакций и в целом функциональную активность клеток
26. Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменения активности ферментов в процессе развития и при болезнях Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие в митохондриях (глутаматдегидрогеназа), третьи - в лизосомах В-глюкуронидаза, кислая фосфатаза) и т. д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Ферменты, которые более или менее специфичны для печеночной ткани. Сюда относятся y-глутамилтранспептидаза, или у-глутамилтрансфераза. Данный фермент - высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени. Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствует о поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. .
27. Наследственные и приобретенные энзимопатии. Изоферменты Энзимопатии (ферментопатии)— патологические изменения активности ферментов. В более узком смысле этим термином обозначают наследственные заболевания, при которых вследствие изменения активности ферментов нарушается течение соответствующих биохимических реакций в организме и развиваются болезни обмена веществ. Приобретенные энзимопатии чаще всего отмечаются у детей после тяжелых, хронически протекающих заболеваний (например, при дизентерии может развиться недостаточность дисахаридаз кишечника). Энзимопатии (ферментопатии) в широком смысле слова — патологические изменения активности ферментов. В более узком смысле этим термином обозначают наследственные заболевания, связанные с существованием блока в ферментных системах, вследствие чего нарушается течение соответствующих химических реакций и развиваются болезни обмена.
28. Витамины. История открытия и изучения витаминов. Функции витаминов. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы. Важность некоторых видов еды для предотвращения определённых болезней была известна ещё в древности. Так, древние египтяне знали, что печень помогает от куриной слепоты. Ныне известно, что куриная слепота может вызываться недостатком витамина A. В 1330 году в Пекине монгол Ху Сыхуэй опубликовал трёхтомный труд «Важные принципы пищи и напитков», систематизировавший знания о терапевтической роли питания и утверждавший необходимость для здоровья комбинировать разнообразные продукты. В 1747 году шотландский врач Джеймс Линд (James Lind) открыл свойство цитрусовых предотвращать цингу. В 1753 году он опубликовал трактат «Лечение цинги». Однако эти взгляды получили признание не сразу. Тем не менее Джеймс Кук на практике доказал роль растительной пищи в предотвращении цинги, введя в корабельный рацион кислую капусту. В результате он не потерял от цинги ни одного матроса — неслыханное достижение для того времени. В 1795 лимоны и другие цитрусовые стали стандартной добавкой к рациону британских моряков. Это послужило появлением крайне обидной клички для матросов — лимонник. Известны т. н. лимонные бунты: матросы выбрасывали за борт бочки с лимонным соком. В 1880 году русский биолог Николай Лунин из Тартуского университета скармливал подопытным мышам по отдельности все известные элементы, из которых состоит коровье молоко: сахар, белки, жиры, углеводы, соли. Мыши погибли. В то же время мыши, которых кормили молоком, нормально развивались. В своей диссертационной (дипломной) работе Лунин сделал вывод о существовании какого-то неизвестного вещества, необходимого для жизни в небольших количествах. Вывод Лунина был принят в штыки научным сообществом. Другие учёные не смогли воспроизвести его результаты. Одна из причин была в том, что Лунин использовал тростниковый сахар, в то время как другие исследователи использовали молочный сахар, плохо очищенный и содержащий некоторое количество витамина B. В последующие годы накапливались данные, свидетельствующие о существовании витаминов. Так, в 1889 году голландский врач Христиан Эйкман обнаружил, что куры при питании варёным белым рисом заболевают бери-бери, а при добавлении в пищу рисовых отрубей — излечиваются. Роль неочищенного риса в предотвращении бери-бери у людей открыта в 1905 году Уильямом Флетчером. В 1906 году Фредерик Хопкинс предположил, что помимо белков, жиров, углеводов и т. д. пища содержит ещё какие-то вещества, необходимые для человеческого организма, которые он назвал «accessory factors». Последний шаг был сделан в 1911 году польским учёным Казимиром Функом(Casimir Funk), работавшим в Лондоне. Он выделил кристаллический препарат, небольшое количество которого излечивало бери-бери. Препарат был назван «Витамайн» (Vitamine), от латинского vita — жизнь и английского amine — амин, азотсодержащее соединение. Функ высказал предположение, что и другие болезни — цинга, пеллагра,рахит — тоже могут вызываться недостатком каких-то веществ. В 1920 году Джек Сесиль Драммонд предложил убрать «e» из слова «vitamine», потому что недавно открытый витамин C не содержал аминового компонента. Так витамайны стали витаминами. В 1929 году Хопкинс и Эйкман за открытие витаминов получили Нобелевскую премию, а Лунин и Функ — не получили. Лунин стал педиатром, и его роль в открытии витаминов была надолго забыта. В 1934 году в Ленинграде состоялась Первая всесоюзная конференция по витаминам, на которую Лунин (ленинградец) не был приглашён. В 1910-е, 1920-е и 1930 годы были открыты и другие витамины. В 1940 годы была расшифрована химическая структура витаминов. По химическому строению и физико-химическим свойствам (в частности, по растворимости) витамины делят на 2 группы.
Водорастворимые
Жирорастворимые
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма. Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма. Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
обмен веществ и процессы минерализации. 29. Витамины группы Д. Провитамины, строение, превращение в активную форму, влияние на Кальциферолы - группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D2 и D3. Витамин D2 (эргокалыщферол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. При облучении пищевых продуктов УФО из эргостерина получается витамин D2, используемый в лечебных целях. Витамин D3, имеющийся у человека и животных, - холекальциферол, образующийся в коже человека из 7-дегидрохолестерина под действием УФ-лучей растворимые в жирах и органических растворителях.
Витамины D2 и D3 - белые кристаллы, жирные на ощупь, нерастворимые в воде, но хорошо
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 472; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.103.10 (0.017 с.) |