Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация белков по химическому составу. Краткая характеристика группы простых белковСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
По химическому составу – простые и сложные Простые белки (протеины) – молекулы состоят только из аминокислот. Подразделяются по растворимости в воде на группы:
Сложные белки (протеиды) – помимо полипептидной цепи имеются небелковые компоненты, представленные углеводами (гликопротеиды), липидами (липопротеиды), нуклеиновыми кислоты (нуклеопротеиды), ионами металла (металлопротеиды), фосфатной группой (фосфопротеиды), пигментами (хромопротеиды) и т. д. Виды сложных белков:
15. Сложные белки: определение, классификация по небелковому компоненту. Краткая характеристика представителей.
Сложные белки (протеиды) – помимо полипептидной цепи имеются небелковые компоненты, представленные углеводами (гликопротеиды), липидами (липопротеиды), нуклеиновыми кислоты (нуклеопротеиды), ионами металла (металлопротеиды), фосфатной группой (фосфопротеиды), пигментами (хромопротеиды) и т. д. Виды сложных белков:
16.Биологические функции белков. Способность к специфическим взаимодействиям («узнавание») как основа биологических функций всех белков. Типы природных лигандов и особенности их взаимодействия с белками.
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют " лиганд ". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично и обратимо, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
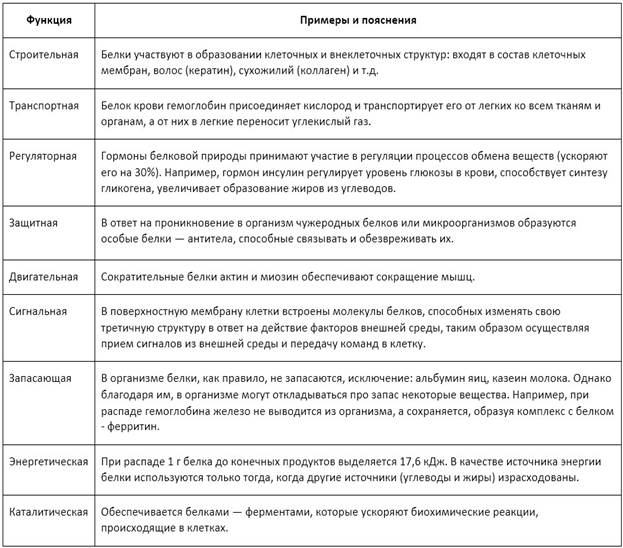
Биологические функции белков:
17. Различие белкового состава органов и тканей. Изменение белкового состава при онтогенезе и болезнях.(ферменты это белковые молекулы кроч одно и тоже) .Различия ферментного состава органов и тканей. Органоспецифические ферменты. Изменение ферментов в процессе развития.
Сравнение множества клеток самых разных типов показывает, что набор содержащихся в них ферментов во многом сходен. По-видимому, во всех живых организмах протекают в основном одни и те же метаболические процессы; некоторые различия, касающиеся конечных продуктов обмена, отражают скорее наличие или отсутствие того или иного фермента, нежели изменение общего характера метаболизма. Сложные системы углеводного обмена, состоящие из ферментов, коферментов и переносчиков, образуют главный поставляющий энергию механизм у животных, растений, плесневых грибов, дрожжей и у большинства других микроорганизмов. Однако в характере метаболизма, химическом составе и строении различных тканей и различных организмов имеются и бесспорные различия. Что касается метаболизма, то особенности его в соответствующих органах или тканях, несомненно, определяются набором ферментов. Различия в химическом составе органов и тканей тоже зависят от их ферментного состава, в первую очередь от тех ферментов, которые участвуют в процессах биосинтеза. Не исключено, что и более очевидные различия, касающиеся строения и формы тех или иных органов и тканей, также имеют энзимологическую природу: Известно, что строение и форма находятся под контролем генов; контроль осуществляется путем образования специфических белков, из которых главными для организации тканей являются ферменты я транспортные системы. Продуктами генов могут быть также белки, не обладающие каталитическими свойствами, но играющие важную роль в «встраивании» ферментных белков в соответствующие структурные ансамбли, например мембраны; однако такие молекулы можно рассматривать как компоненты катализаторов, поскольку они находятся в теснейшей взаимосвязи с ними.
Изменение активности ферментов при болезнях. Наследственные энзимопатии. Происхождение ферментов крови и значение их определения при болезнях. В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. Приобретённые энзимопатии, как и вообще протеинопатии, по-видимому, наблюдают при всех болезнях. При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей. При этом развитие заболевания может протекать
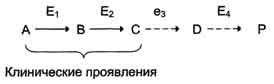
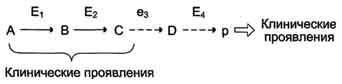
по одному из ниже перечисленных "сценариев". Рассмотрим условную схему метаболического пути:
Вещество А в результате последовательных ферментативных реакций превращается в продукт Р. При наследственной недостаточности какого-либо фермента, например фермента Е3, возможны разные нарушения метаболических путей: Нарушение образования конечных продуктов. Недостаток конечного продукта этого метаболического пути (Р) (при отсутствии альтернативных путей синтеза) может приводить к развитию клинических симптомов, характерных для данного заболевания:
· Клинические проявления. В качестве примера можно рассмотреть альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов Накопление субстратов-предшественников. При недостаточности фермента Е3 будут накапливаться вещество С, а также во многих случаях и предшествующие соединения. Увеличение субстратов-предшественников дефектного фермента - ведущее звено развития многих заболеваний:
· Клинические проявления. Известно заболевание алкапгонурия, при котором нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность. Нарушение образования конечных продуктов и накопление субстратов предшественников. Отмечают заболевания, когда одновременно недостаток продукта и накопление исходного субстрата вызывают клинические проявления.
· Клинические проявления. Например, у людей с болезнью Гирке (гликогеноз I типа) наблюдают снижение концентрации глюкозы в крови (гипогликемия) в перерывах между приёмами пищи. Это связано с нарушением распада гликогена в печени и выходом из неё глюкозы вследствие дефекта фермента глюкозо-6-фосфатфосфатазы. Одновременно у таких людей увеличиваются размеры печени (гепатомегалия) вследствие накопления в ней не используемого гликогена.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличиваетсяактивность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. озрастание активности ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося ихбиосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих вкровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществсвязано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.
18. Ферменты, история открытия. Особенности ферментативного катализа. Специфичность действия ферментов. Классификация и номенклатура ферментов.
Термин фермент предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения. В кон. ХVIII — нач. XIX вв. уже было известно, что мясо переваривается желудочным соком, а крахмал превращается в сахар под действием слюны. Однако механизм этих явлений был неизвестен В XIX в. Луи Пастер, изучая превращение углеводов в этиловый спирт под действием дрожжей, пришел к выводу, что этот процесс (брожение) катализируется некой жизненной силой, находящейся в дрожжевых клетках. Более ста лет назад термины фермент и энзим отражали различные точки зрения в теоретическом споре Л. Пастера с одной стороны, и М. Бертло и Ю. Либиха — с другой, о природе спиртового брожения. Собственно ферментами (от лат. fermentum — закваска) называли «организованные ферменты» (то есть сами живые микроорганизмы), а термин энзим (от греч. ἐν- — в- и ζύμη — дрожжи, закваска) предложен в 1876 году В. Кюне для «неорганизованных ферментов», секретируемых клетками, например, в желудок (пепсин) или кишечник (трипсин, амилаза). Через два года после смерти Л. Пастера в 1897 году Э. Бухнер опубликовал работу «Спиртовое брожение без дрожжевых клеток», в которой экспериментально показал, что бесклеточный дрожжевой сок осуществляет спиртовое брожение так же, как и неразрушенные дрожжевые клетки. В 1907 году за эту работу он был удостоен Нобелевской премии. Впервые высокоочищенный кристаллический фермент (уреаза) был выделен в 1926 году Дж. Самнером. В течение последующих 10 лет было выделено еще несколько ферментов, и белковая природа ферментов была окончательно доказана.
Каталитическая активность РНК впервые была обнаружена в 1980-е годы у пре-рРНК Томасом Чеком, изучавшим сплайсинг РНК у инфузории Tetrahymena thermophila.Рибозимом оказался участок молекулы пре-рРНК Tetrahymena, кодируемый интроном внехромосомного гена рДНК; этот участок осуществлял аутосплайсинг, то есть сам вырезал себя при созревании рРНК. Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям. Ферменты увеличивают скорость превращения субстрата по сравнению с неферментативной реакцией в 109-1012 раз. Столь высокая эффективность обусловлена особенностями строения активного центра. Принято считать, что активный центр комплементарен переходному состоянию субстрата при превращении его в продукт. Благодаря этому стабилизируется переходное состояние и понижается активационный барьер. Большинство ферментов обладает высокой субстратной специфичностью, т. е. способностью катализировать превращение только одного или несколько близких по структуре веществ. Специфичность определяется топографией связывающего субстрат участка активного центра. Активность ферментов регулируется в процессе их биосинтеза (в т.ч. благодаря образованию изоферментов, которы катализируют идентичные реакции, но отличаются строением и каталитическими свойствами), а также условиями среды (рН, температура, ионная сила раствора) и многочисленными ингибиторами и активаторами, присутствующими в организме. Ингибиторами и активаторами могут служить сами субстраты (в определенных концентрациях), продукты реакции, а также конечные продукты в цепи последовательных превращений вещества Ферментативные реакции чувствительны к внешним условиям, в частности к ионной силе раствора и рН среды. Влияние температуры на скорость ферментативной реакции описывается кривой с максимумом, восходящая ветвь которой отражает обычную для химической реакций зависимость, выраженную уравнением Аррениуса. Нисходящая ветвь связана с тепловой денатурацией фермента. Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться". В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением: Е + S ↔ ES ↔ ЕР ↔ Е + Р, где Е - фермент (энзим), S - субстрат, Р - продукт. Специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра. Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают: 1. абсолютную субстратную специфичность; 2. групповую субстратную специфичность; 3. стереоспецифичность. Абсолютная субстратная специфичность. Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. Каталитическая специфичность Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Скорость ферментативной реакции зависит от ряда факторов, таких как количество и активность ферментов, концентрация субстрата, температура среды, рН раствора, присутствие регуляторных молекул (активаторов и ингибиторов). Зависимость скорости ферментативной реакции от количества ферментов. При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов. Количество единиц активности nME определяют по формуле:
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани. По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. Зависимость скорости ферментативной реакции от температуры среды. Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы. Зависимость скорости ферментативной реакции от рН среды Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности. Оптимум значения рН у разных ферментов различный. Ферменты, работающие в кислых условиях среды (например, пепсин в желудке или лизосомальные ферменты), эволюционно приобретают конформацию, обеспечивающую работу фермента при кислых значениях рН. Однако большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН. Зависимость скорости ферментативной реакции от количества субстрата. Если концентрацию ферментов оставить постоянной, изменяя только количество субстрата, то график скорости ферментативной реакции описывают гиперболой. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Ферментативный процесс можно выразить следующим уравнением:
где k1 - константа скорости образования фермент-субстратного комплекса; k-1 - константа скорости обратной реакции, распада фермент-субстратного комплекса; k2 - константа скорости образования продукта реакции.
.Классификация и номенклатура ферментов. Изоферменты. Единицы измерения активности и количества ферментов. Каждый фермент имеет 2 названия. Первое - короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) - систематическое, применяемое для однозначной идентификации фермента. Рабочее название. В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин. Классы ферментов. Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним. 1. Оксидоредуктазы. Катализируют различные окислительно-восстановительные реакции с участием 2 субстратов (перенос е- или атомов водорода с одного субстрата на другой). 2. Трансферазы. Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой группы. 3. Гидролазы. Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи. 4. Лиазы. К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут отщепляться СО2, Н2О, NH2,SН2и др.) или присоединяющие чаще всего молекулу воды по двойной связи. 5. Изомеразы. Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации. 6. Лигазы (синтетазы). Катализируют реакции присоединения друг к другу двух молекул с образованием ковалент-ной связи. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом макроэргических связей других соединений. В первом случае (при использовании энергии гидролиза АТФ) такие ферменты называют лигазами, или синтетазами Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одноморганизме, но, как правило, в разных его клетках, тканях или органах. Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам. Одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов . Количество единиц активности nME определяют по формуле:
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Международная единица ферментативной активности ME связана с каталом следующими равенствами: 1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME, 1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат. В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (nМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани.
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 2398; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.128.168.176 (0.012 с.) |

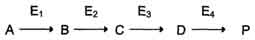
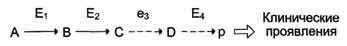
 .
.